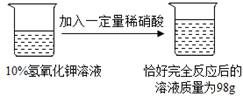
题目内容
有NaCl 和Na2CO3的混合物样品4g,为了测定该混合物中Na2CO3的质量分数,现将足量盐酸加到此混合物中,得到部分数据与图像。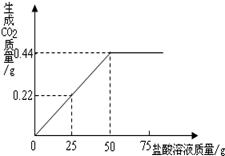
① 样品完全反应后,共放出二氧化碳气体的物质
的量为 mol。
② 计算混合物中Na2CO3的质量分数。
(根据化学方程式列式计算)
(1)0.01;(2)26.5%
解析

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
有铁粉和铜粉的均匀混合物,甲、乙、丙三位同学分别取该混合物与稀硫酸反应,所得数据如表所示:
| | 甲 | 乙 | 丙 |
| 金属混合物质量/g | 10 | 10 | 20 |
| 稀硫酸质量/g | 100 | 120 | 100 |
| 剩余固体质量/g | 4 | 4 | 13 |
请分析数据,回答下列问题:
(1)甲同学所得溶液中含有的溶质是 .
(2)计算丙同学所得溶液中溶质的质量分数.(计算结果精确到0.1%)
石灰石样品的主要成分是CaCO3(已知其它杂质不与盐酸反应).课外小组同学将50g盐酸分5次加入到20g该石灰石样品中,得到如下部分数据和图象:
| 次数 | 第1次 | 第2次 | 第3次 |
| 加入盐酸的质量/g | 10 | 10 | 10 |
| 剩余固体的质量/g | 16 | 12 | 8 |
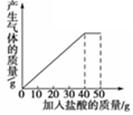
请计算:
(1)石灰石样品中杂质的质量为 g。
(2)所加盐酸的溶质质量分数.
(7分)学过金属活动性后,秦思同学通过实验探究锌粉与硝酸亚铁和硝酸银两种盐溶液的反应。实验现象和数据如下: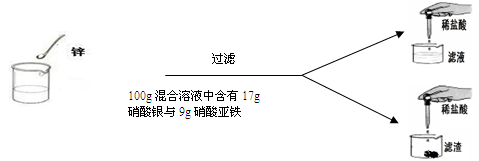
| | 第一次 | 第二次 | 第三次 | 第四次 |
| 硝酸亚铁与硝酸银的混合溶液 | 100g | 100g | 100g | 100g |
| 锌粉 | 2g | 3.25g | m | 9.75g |
| 向滤液中加入稀盐酸后的实验现象 | 产生白色沉淀 | 无明显现象 | 无明显现象 | 无明显现象 |
| 向滤渣中加入100 g稀盐酸后的实验现象 | 无明显现象 | 无明显现象 | 产生气泡,溶液变为浅绿色 | 现象与第三次相同 |
(2)根据第一次的实验现象,你认为此次滤液中的溶质是 ;
(3)根据已知条件列出求解第二次实验中置换出金属银的质量(x)的比例式 ;
(4)若第三次实验锌与两种盐溶液恰好完全反应,则m的质量为__________________;
(5)若向第三次反应后的滤液中加入一定质量的水,所得不饱和溶液中溶质的质量分数为10%,则加入水的质量为__________________;
(6)若用溶质质量分数为36.5%的浓盐酸配制第四次实验中与滤渣恰好完全反应所需的稀盐酸,则需要浓盐酸与水的质量比为_______________。
(7分))课外活动时,同学们采用以下两种方法测定某氯化钠溶液的溶质质量分数。
(1)【化学方法】向一定量氯化钠溶液中加入足量硝酸银溶液,得到2.87g氯化银固体,则该氯化钠溶液中氯化钠的质量为多少?(根据化学方程式列式计算)
经多次实验测定,该溶液的溶质质量分数为10%。
(2)【物理方法】取一定量该溶液进行蒸发,测量实验数据如下:
| 蒸发皿的质量(g) | 25.0 |
| 蒸发皿+食盐溶液(g) | 45.0 |
| 蒸发皿+食盐晶体(g) | 27.4 |
| 数据处理 | 溶液的溶质质量分数为 |
A.蒸发时未用玻璃棒搅拌
B.所取氯化钠溶液质量较大
C.蒸发时出现少量晶体时就停止加热
D.实验后未将玻璃棒上的白色固体移入蒸发皿