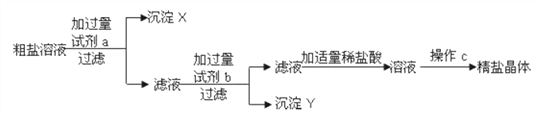
题目内容
【题目】用氢氧化钠溶液、稀盐酸和酚酞溶液.按如图步骤进行实验.
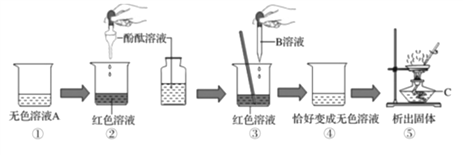
回答下列问题
(1)无色溶液A是______________,仪器C的名称是_____________.
(2)实验中滴入酚酞溶液的目的是___________;
(3)实验中反应的化学方程式是_______________;
(4)步骤⑤的操作名称是________,当出现较多量固体时应___________________。
【答案】 氢氧化钠溶液 酒精灯; 证明盐酸能与氢氧化钠发生化学反应; NaOH+HCl═NaCl+H2O; 蒸发 停止加热,用余热烘干。
【解析】(1)酚酞溶液遇碱性溶液变红,氢氧化钠溶液显碱性,稀盐酸显酸性。酒精灯是一种常用的加热仪器。(2)实验中滴入酚酞溶液的目的是证明盐酸能与氢氧化钠发生化学反应。(3)酸碱反应生成盐和水。(4)步骤⑤的操作是蒸发,当出现较多量固体时应停止加热,利用余热可使水分蒸干。

【题目】金属材料和水在生产和生活中有着广泛应用。
① 水是很好的溶剂。下表是 NaCl 和 KNO3 在不同温度时的溶解度,回答问题。
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度 | NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
(g/100g 水) | KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110.0 |
I.两种物质中,溶解度受温度影响变化较大的是______;
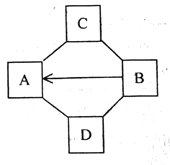
II.60℃时,按图示操作

A 中溶液是_______(填“饱和”或“不饱和”)溶液,C 中溶液的总质量是_______g;
III.50℃时,将两种物质的饱和溶液各 100 g,分别加热蒸发 10 g 水后,再恢复到 50℃, 则以下说法正确的是______(选填编号)。
a.有 NaCl 晶体析出,无 KNO3 晶体析出
b.两溶液中溶质与溶剂的质量比都增大
c.剩余溶液的质量:NaCl 溶液大于 KNO3 溶液 d.析出 NaCl 晶体 3.7 g
② 铁制品在潮湿空气中容易生锈,请写出工业上除铁锈的方法_________(用化学方程式表示)。
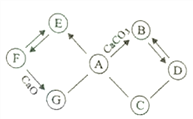
③ 某同学将一定质量的 Zn 粉放入 AgNO3 与 Cu(NO3)2 的混合溶液中,实验流程如图所示:
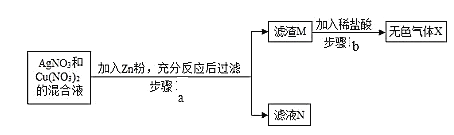
I.步骤 b 中生成的无色气体 X 是_________,滤液 N 中的溶质是_____;
II.步骤 a 中发生反应的化学方程式____(任写一个即可)。
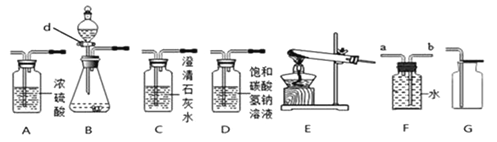
【题目】利用下图装置探究物质的性质(部分固定装置略)。

①仪器 a 的名称___________; 装置 A 中反应的化学方程式___________。
②装置 C 的作用___________;装置 D 中反应的化学方程式为___________ 。
③ 装置 E 中固体由黑色变成亮红色,反应化学方程式为___________;
④ 装置 F 是安全瓶,其作用是___________。
⑤把装置 A 中换成酒精灯,可用于氯酸钾与二氧化锰混合制取氧气。 试管中固体的质量随反应时间变化的数据见下表。
反应时间/min | 0 | t1 | t2 | t3 |
固体质量/g | 26.0 | 20.2 | 16.4 | 16.4 |
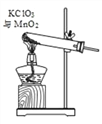
Ⅰ.共制得氧气的质量是_________g;
Ⅱ.参加反应的氯酸钾的物质的量是_________mol(通过化学方程式列式计算)。