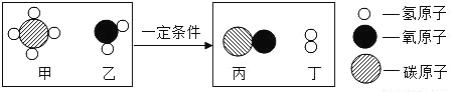
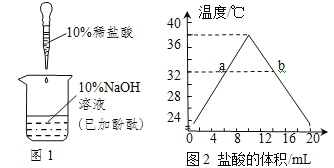
题目内容
【题目】某粗盐样品中含有杂质氯化镁、氯化钙。小林设计了以下提纯方案:
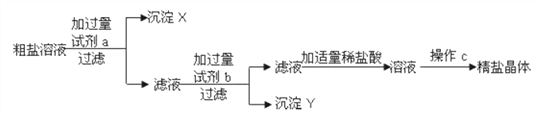
若方案中先除去的是氯化镁,接着除去氯化钙,请回答:
(1)试剂b的化学式是_____________。
(2)操作过程中加适量稀盐酸时, 发生的反应化学方程式是________、________。
(3)若所取粗盐样品中实际含氯化钠的质量为mg,除杂后所得精盐的质量为ng,则m与n的关系是m _____n(填“>”“=”“<”),原因是_______________。
【答案】 Na2CO3 NaOH + HCl == NaCl + H2O Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑ ﹤ 除杂过程中又产生了NaCl
【解析】(1)①除去杂质实际是除去杂质的离子,除杂质不能引入新的杂质,镁离子和钙离子是杂质的离子,要将镁离子沉淀需要氢氧根离子,要将钙离子沉淀需要碳酸根离子,所以先加入过量的氢氧化钠溶液,除去氯化镁,再加入过量的碳酸钠溶液,除去氯化钙;(2)加入的氢氧化钠和碳酸钠都是过量的,滤液中有反应剩余的氢氧化钠和盐酸反应生成氯化钠和水,碳酸钠与盐酸反应,生成氯化钠、水、二氧化碳,发生的反应化学方程式分别是NaOH + HCl = NaCl + H2O、Na2CO3 + 2HCl =2NaCl + H2O + CO2↑;(3)氢氧化钠和氯化镁反应生成氯化钠和氢氧化镁沉淀,碳酸钠和氯化钙反应生成氯化钠和碳酸钙沉淀,除杂过程中有新生成的NaCl,所以所得精盐的质量增大。

练习册系列答案
相关题目