题目内容
【题目】工业上以大理石和赤铁矿为主要原料制取B和G,其转化关系如图所示,已知D、G为单质。回答下列问题:

(1)写出物质的化学式:B______,G______;
(2)C的一种用途是______;
(3)反应①的基本反应类型为______;
(4)写出反应③的化学方程式:______。
【答案】CaO Fe 灭火 分解反应 3CO+Fe2O3![]() 2Fe+3CO2
2Fe+3CO2
【解析】
大理石高温分解能生成氧化钙和二氧化碳,则B和C为氧化钙或二氧化碳中的一种,C能与单质D在高温下又会生成E,所以C是二氧化碳,B是氧化钙,D与二氧化碳高温反应生成E,E能与氧化铁高温反应生成二氧化碳和单质G,根据质量守恒定律,可以推出E是一氧化碳,G是铁,所以D就是木炭,将推出的物质带入框图,推断合理。
由分析可知![]() 所以B的化学式为:CaO,G的化学式为:Fe;
所以B的化学式为:CaO,G的化学式为:Fe;
![]() 是二氧化碳,能用于灭火;
是二氧化碳,能用于灭火;
![]() 反应①是碳酸钙高温分解生成氧化钙和二氧化碳,属于分解反应;
反应①是碳酸钙高温分解生成氧化钙和二氧化碳,属于分解反应;
![]() 反应③是氧化铁和一氧化碳在高温的条件下反应生成铁和二氧化碳,化学方程为:3CO+Fe2O3
反应③是氧化铁和一氧化碳在高温的条件下反应生成铁和二氧化碳,化学方程为:3CO+Fe2O3![]() 2Fe+3CO2。
2Fe+3CO2。

 寒假乐园北京教育出版社系列答案
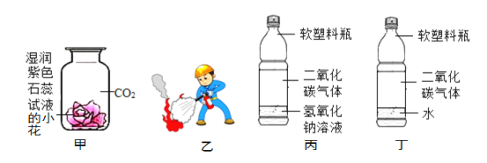
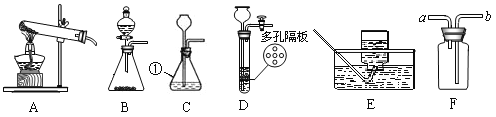
寒假乐园北京教育出版社系列答案【题目】(1)请根据下列实验装置图回答问题
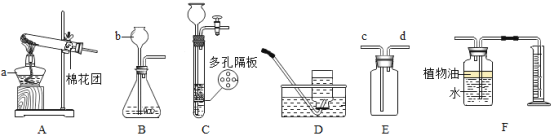
①写出下列仪器名称:b______
②若用氯酸钾与二氧化锰固体加热制取氧气,应选择的发生装置是______,若用E装置装满水将水排出收集氧气,则氧气应从______![]() 填“c”或“d”
填“c”或“d”![]() 口通入
口通入
③装置B、C都可用来制取二氧化碳,装置C相对于装置B在操作方面的优势是______。
④若用F收集![]() 并测量生成的
并测量生成的![]() 气体的体积,其中在水面上放一层植物油目的是______。
气体的体积,其中在水面上放一层植物油目的是______。
(2)某校探究小组,误把稀盐酸倒入盛有氢氧化钙溶液的烧杯中,于是他们对烧杯内溶液中溶质成分进行了探究。
I.写出该反应的化学方程式:______
![]() 探究烧杯内溶液的溶质的成分。
探究烧杯内溶液的溶质的成分。
(提出问题)该烧杯内溶液中的溶质是什么?
(猜想)
猜想一:可能是![]() 和
和![]()
猜想二:可能只有![]() ;
;
猜想三:______
(查阅资料)氯化钙溶液呈中性。
(实验探究)
实验步骤 | 实验现象 | 实验结论 |
取少量烧杯内溶液于试管中,滴入几滴酚酞试液,振荡。 | ______ | 猜想一不正确。 |
取少量烧杯内溶液于另一只 试管中,滴加碳酸钠溶液。 | ______ | 猜想二不正确,猜想三正确。 |
(反思与拓展)
烧杯中的溶液末经处理直按倒入下水道,可能造成的危害是______![]() 写一条
写一条![]() 。要处理烧杯内溶液,使其溶质只含有
。要处理烧杯内溶液,使其溶质只含有![]() ,应向烧杯中加入过量的______。
,应向烧杯中加入过量的______。