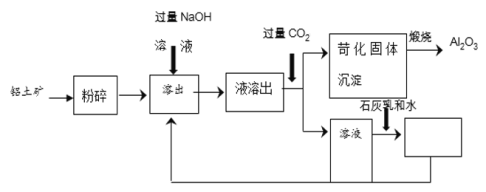
题目内容
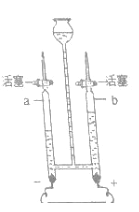
【题目】请结合图示实验装置,回答下列问题。
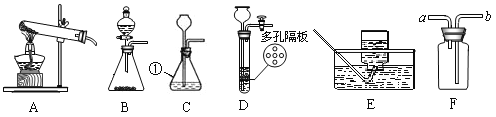
(1)写出标号①的仪器名称:__________。
(2)实验室用氯酸钾和二氧化锰制取氧气应选择的发生装置是_____ (选填序号),反应的化学方程式为______。
(3)若B装置中固体为二氧化锰,分液漏斗中加入______可制氧气,反应的化学方程式为______。
(4)可用C或D装置制二氧化碳, D相对于C装置的优点有______。
(5)若用E装置收集氧气,当导管口有气泡______时才能将导管伸入集气瓶中。用E装置收集氧气的原因是_______。若用F装置收集二氧化碳,气体应从_____端通入 (选填“a”或“b”)。
【答案】锥形瓶 A 2KClO3![]() 2KCl+3O2↑ 双氧水(或过氧化氢溶液) 2H2O2
2KCl+3O2↑ 双氧水(或过氧化氢溶液) 2H2O2![]() 2H2O+O2↑ 控制反应的发生和停止 连续均匀冒出 氧气不易溶于水且不与水反应(或者氧气不易溶于水) b
2H2O+O2↑ 控制反应的发生和停止 连续均匀冒出 氧气不易溶于水且不与水反应(或者氧气不易溶于水) b
【解析】
(1)锥形瓶是常用的反应容器;
(2)制取装置包括加热和不需加热两种,如果用高锰酸钾或氯酸钾制氧气就需要加热。氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集;
(3)如果用双氧水和二氧化锰制氧气就不需要加热,过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,要注意配平;
(4)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热。二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集;
(5)用排水法收集较纯净氧气的适宜时间是:当导管口有连续均匀气泡冒出时;氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集;若用F装置收集二氧化碳,气体应从长管进入,因为二氧化碳的密度比空气大。
(1)据图可知仪器①锥形瓶;
(2)如果用氯酸钾制氧气就需要加热,可选装置A;高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,反应的化学方程式为:2KClO3![]() 2KCl+3O2↑;
2KCl+3O2↑;
(3)如果用双氧水和二氧化锰制氧气就不需要加热,过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,反应的化学方程式为:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(4)D相对于C装置的优点有:控制反应的发生和停止;
(5)用排水法收集较纯净氧气的适宜时间是:当导管口有连续均匀气泡冒出时;氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集;若用F装置收集二氧化碳,气体应从长管进入,因为二氧化碳的密度比空气大。

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案