题目内容
【题目】在化学实验课上,小组同学利用回收的二氧化锰来催化过氧化型制取氧气,但发现利用回收的二氧化锰作为催化剂反应速率很慢.查阅资料得知:催化剂在催化过程中催化剂的活性减弱或失去,这种现象叫做催化剂的中毒.为了探究影响二氧化锰催化能力降低的因素,在老师的指导下,小组同学进行如下实验:
(实验准备)
取三份质量均为1克的二氧化锰分别催化50毫升溶质质量分数为5%、15%、25%的过氧化氢溶液分解,试验后回收二氧化锰,并分别标为②、③、④;另取多次催化分解5%过氧化氢实验后回收的二氧化锰,标为⑤。
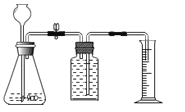
(实验步骤)
(1)连接仪器,检查装置气密性,检查该实验气体发生装置气密性的方法是_______。
(2)取未使用过的二氧化锰0.5克,标为①,加入锥形瓶中,再加入10毫升溶质质量分数为5%的过氧化氢溶液,记录收集20s时间气体的体积.
(3)再分别取②、③、④、⑤组二氧化锰各0.5克,重复上述实验。
(4)采取多次实验取平均值的方法,实验数据记录如下:
组别 | ① | ② | ③ | ④ | ⑤ |
收集气体体积/ml | 118 | 92 | 87 | 77 | 62 |
(回答下列问题)
①实验过程中量筒的作用是________
②实验中,除了通过比较收集相同时间内产生的气体体积,还可以通过比较_________来对比二氧化锰的催化效果。锥形瓶中残留的空气对测量结果_________(填“有”或“没有”)。
③请写出该实验反应的符号表达式__________
(5)由表中实验_______(填实验序号)数据可知,影响回收的二氧化锰催化效率下降的因素有二氧化锰的使用次数。由表中实验数据②、③、④数据可知,影响回收的二氧化锰催化效率下降的因素是______
(进一步探究)化学课本告诉我们,硫酸铜溶液也可以催化过氧化氢溶液的分解。小明通过前面的学习想知道硫酸铜是离子构成的,想知道硫酸铜溶液中的哪种粒子对过氧化氢溶液分解有催化作用产生了好奇。
(查阅资料)硫酸铜溶液中有铜离子、硫酸根离子和水分子;硫酸钠溶液中有钠离子,硫酸根离子和水分子。
(实验设计)
①根据所学知识判断水分子对过氧化氢分解_______(填“有”或“没有”)催化作用。
②提供药品:5%的过氧化氢溶液、硫酸铜溶液、硫酸钠溶液,仪器自选。请设计实验欲证明是铜离子对过氧化氢有催化作用____________(包括操作、现象、结论)。
【答案】用止水夹夹紧胶皮管,向长颈漏斗中加水,如果长颈漏斗内能形成一段稳定的水柱,证明气密性良好 测量排出水的体积,从而测出生成氧气的体积 比较产生相同体积的气体所需时间 没有 H2O2![]() H2O+O2 ②和⑤ 过氧化氢溶液的溶质质量分数 没有 向盛有5mL 15%的过氧化氢溶液的试管中加入少量硫酸铜溶液,把带火星的木条伸入试管中,木条复燃;再向盛有5mL 15%的过氧化氢溶液的另外一支试管中加入少量硫酸钠溶液,把带火星的木条伸入试管中,木条不复燃,证明起催化作用的是铜离子
H2O+O2 ②和⑤ 过氧化氢溶液的溶质质量分数 没有 向盛有5mL 15%的过氧化氢溶液的试管中加入少量硫酸铜溶液,把带火星的木条伸入试管中,木条复燃;再向盛有5mL 15%的过氧化氢溶液的另外一支试管中加入少量硫酸钠溶液,把带火星的木条伸入试管中,木条不复燃,证明起催化作用的是铜离子
【解析】
(1)检查该实验气体发生装置气密性的方法是:用止水夹夹紧胶皮管,向长颈漏斗中加水,如果长颈漏斗内能形成一段稳定的水柱,证明气密性良好。
故填:用止水夹夹紧胶皮管,向长颈漏斗中加水,如果长颈漏斗内能形成一段稳定的水柱,证明气密性良好。
(4)①排出水的体积等于生成氧气的体积,所以实验过程中量筒的作用是测量排出水的体积,从而测出生成氧气的体积;故填:测量排出水的体积,从而测出生成氧气的体积。
②用控制变量法,题中所给的方法是相同时间内产生的气体体积,还可以比较产生相同体积的气体所需时间来反映二氧化锰的催化能力;锥形瓶中残留的空气对测量结果没有影响,原因是每次实验锥形瓶内残留的空气体积相同即可;故填:比较产生相同体积的气体所需时间;没有。
③过氧化氢在二氧化锰催化作用下生成氧气和水,反应的符号表达式为:H2O2![]() H2O+O2;故填:H2O2
H2O+O2;故填:H2O2![]() H2O+O2。
H2O+O2。
(5)由表中实验②和⑤数据可知,过氧化氢溶液质量分数相同时,二氧化锰使用的次数越少,生成相同氧气的时间越少;由表中实验数据②、③、④数据可知,影响回收的二氧化锰催化效率下降的因素是:过氧化氢溶液的溶质质量分数;故填:②和⑤;过氧化氢溶液的溶质质量分数。
[进一步探究]①过氧化氢溶液中含有水分子,所以水不可能是催化剂;故填:没有;
②硫酸铜溶液中含有铜离子,所以实验方案是:向盛有5mL 15%的过氧化氢溶液的试管中加入少量硫酸铜溶液,把带火星的木条伸入试管中,木条复燃;再向另外盛有5mL 15%的过氧化氢溶液的另外一支试管中加入少量硫酸钠溶液,把带火星的木条伸入试管中,木条不复燃,证明起催化作用的是铜离子;
故填:向盛有5mL 15%的过氧化氢溶液的试管中加入少量硫酸铜溶液,把带火星的木条伸入试管中,木条复燃;再向盛有5mL 15%的过氧化氢溶液的另外一支试管中加入少量硫酸钠溶液,把带火星的木条伸入试管中,木条不复燃,证明起催化作用的是铜离子。

【题目】下表是我国颁布的生活饮用水水质标准的部分内容。
项目 | 标准 |
感官指标 | 无异味、异臭等 |
化学指标 | pH 6.5~8.5,铜<1.0mgL-1,氟化物<1.0mgL-1,游离氯≥0.3mgL-1等 |
⑴感官指标表现的是自来水的______性质(填“物理”或“化学”);若化学指标中的 pH=8时,表明自来水呈________ (填“酸性”、“碱性”或“中性”)。
⑵天然水中含有许多杂质,可利用吸附、沉淀、过滤和蒸馏等方法净化,其中净化程度最高的方法是__________。
⑶硬水给生活和生产带来很多麻烦,生活中可用______来区分硬水和软水,常用______的方法来降低水的硬度。
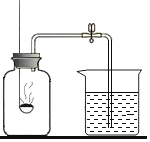
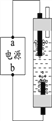
⑷液氯可以作为饮用水消毒剂。下图是一种家用环保型消毒液发生器,其中发生的主要反应是氯化钠和水在通电条件下反应生成氢氧化钠、氢气 和氯气,该反应的化学方程式为________;从能量变化角度看,该反应中将________能转化为化学能。
⑸饮用水消毒剂除了液氯以外,还有氯胺(NH2Cl)、臭氧(O3)等。O3中氧元素的化合价是_____。NH2Cl中氯元素与氢元素的质量比是_________。
⑹ClO2是新一代饮用水的消毒剂,可以用来代替Cl2进行自来水的消毒。制取ClO2的反应过程示意图如下:
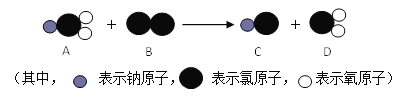
该反应的化学方程式是_________________。
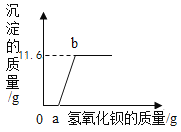
【题目】实验室现有硫酸铜和硫酸钠的固体混合物样品,小明同学想测定样品中硫酸铜的质量分数。先称取该混合物样品25g,完全溶于水中,然后取用了一定溶质质量分数的氢氧化钠溶液100g平均分四次加入其中,充分振荡,实验所得数据见下表,请你分析并进行有关计算:
次数/物质的质量 | 1 | 2 | 3 | 4 |
加入氢氧化钠溶液的质量/g | 25 | 25 | 25 | 25 |
生成沉淀的质量/g | 4.9 | x | 14.7 | 14.7 |
(1)表中X的数值为________________;
(2)计算原固体混合物样品中硫酸铜的质量分数为___________?
(3)上述实验中所用到的氢氧化钠溶液,是小海同学利用实验室中已有的80g溶质质量分数为40%的氢氧化钠溶液配置的,计算需加入______克水(只写计算结果),才能配成实验中所需溶质质量分数的氢氧化钠溶液.
【题目】下列化学知识归纳整理的相关内容中完全正确的一组是:
A.数轴表示 | B.化学巨匠及杰出贡献 |
① ② | ①张青莲--测量相对原子质量 ②侯德榜--发明联合制盐法 |
C.实验操作的先后顺序 | D.化学元素与人体健康 |
①点燃可燃性气体——先验纯后点燃 ②CO还原CuO——先加热后通入CO | ①缺铁元素--会引起贫血 ②缺碘元素--会引起甲状腺肿大 |
A.AB.BC.CD.D