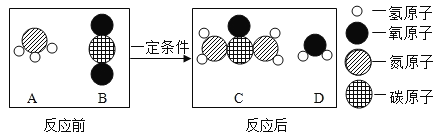
题目内容
【题目】(1)小明用传感器探究稀氢氧化钠溶液与稀盐酸反应过程中温度和 pH 的变化。测定结果如图所示。根据图示回答下列问题:

氢氧化钠和盐酸的反应属于______填“吸热”或“放 热”)反应。写出 61s 时,溶液中溶质的化学式_____。
(2)某化学小组用一定量的 AgNO3 和 Cu(NO3)2 的混合溶液进行了如图所示的实验,并对溶液 A 和固体 B 的成分进行了分析和实验探究。

(提出问题)溶液A中的溶质成分可能有哪些?
(做出猜想)猜想①:只有 Zn(NO3)2;
猜想②:有 Zn(NO3)2、Cu(NO3)2;
猜想③: 有 Zn(NO3)2、AgNO3;
猜想④:有 Zn(NO3)2、Cu(NO3)2、AgNO3
(交流讨论)不合理的猜想是_____(填序号),其理由是_____。
(实验探究)若猜想①成立,通过以下实验可确定固体的成分,请将下表填写完整
实验步骤 | 现象 | 有关反应的化学方程式 |
取少量固体,滴加_____ | 有气泡产生 | _____ |
(深入思考)若猜想④成立,固体 B 的成分是_____。
(3)除去 NaCl 溶液中 CaCl2 、MgCl2、Na2SO4 杂质的操作:①加过量的 NaOH 溶液;②加过量的 BaCl2 溶液;③过滤;④加适量的盐酸;⑤加过量的 Na2CO3 溶液。
(提示:Mg(NO3)2、BaSO4、BaCO3 难溶于水)写出以上操作的合理顺序_____(数字序号不能重复使用)。请写出溶液 BaCl2 与 Na2SO4 溶液反应的化学方程式_____。
(4)上述试剂中的 Na2CO3 溶液不能用 K2CO3 溶液代替,请说明原因_____。
【答案】放热 ![]() 猜想③ 锌先与硝酸银反应,后与硝酸铜反应,当含有硝酸银时,一定含有硝酸铜。 稀盐酸
猜想③ 锌先与硝酸银反应,后与硝酸铜反应,当含有硝酸银时,一定含有硝酸铜。 稀盐酸 ![]() 银 ①②⑤③④
银 ①②⑤③④ ![]() 碳酸钾和氯化钡、氯化钙、稀盐酸反应生成氯化钾,会引入新的杂质
碳酸钾和氯化钡、氯化钙、稀盐酸反应生成氯化钾,会引入新的杂质
【解析】
氢氧化钠和盐酸反应生成氯化钠和水,锌和硝酸银反应生成硝酸锌和银,锌和硝酸铜反应生成硝酸锌和铜,硫酸钠和氯化钡生成硫酸钡和氯化钠,碳酸钾和氯化钡反应生成碳酸钡和氯化钾,氯化钙和碳酸钾反应生成碳酸钙和氯化钾,碳酸钾和稀盐酸反应生成氯化钾、水和二氧化碳。
(1)向稀盐酸中滴加氢氧化钠溶液时,溶液的温度在升高,故氢氧化钠和盐酸反应属于放热反应,开始溶液的pH小于7,最终溶液的pH大于7,说明是氢氧化钠溶液加入稀盐酸中,61s时,氢氧化钠过量,溶液中溶质是稀盐酸和氢氧化钠生成的氯化钠和过量的氢氧化钠,故化学式为![]() 。
。
(2)[交流讨论]一定量的 AgNO3 和 Cu(NO3)2 的混合溶液中加入锌粉,锌先和硝酸银反应生成硝酸锌和银,然后锌和硝酸铜反应生成硝酸锌和铜,当溶质中含有硝酸银时,硝酸铜没有参加反应,锌反应完全,则有硝酸银存在时,一定含有硝酸铜,故不合理的猜想是猜想③,理由是锌先与硝酸银反应,后与硝酸铜反应,当含有硝酸银时,一定含有硝酸铜。
[实验探究]猜想①成立,有气泡产生,锌过量,只有硝酸锌,锌和稀盐酸反应生成氯化锌和氢气。
实验步骤 | 现象 | 有关反应的化学方程式 |
取少量固体,滴加稀盐酸 | 有气泡产生 | |
[深入思考]若猜想④成立,溶质含有Zn(NO3)2、Cu(NO3)2、AgNO3,说明锌粉反应完全且硝酸银有剩余,锌和硝酸银反应生成银和硝酸锌,故固体B的成分是银。
(3)在除杂质时,加入碳酸钠应在加入氯化钡之后,加入稀盐酸应在过滤之后,MgCl2可用NaOH溶液除去,Na2SO4可用BaCl2溶液除去,CaCl2和过量的BaCl2溶液可用Na2CO3溶液;过量的碳酸钠、氢氧化钠可用稀盐酸除去,故正确的操作先后顺序是①②⑤③④,溶液 BaCl2 与 Na2SO4 溶液反应是硫酸钠和氯化钡生成硫酸钡和氯化钠,反应的化学方程式为![]() 。
。
(4)碳酸钾和氯化钡反应生成碳酸钡和氯化钾,氯化钙和碳酸钾反应生成碳酸钙和氯化钾,碳酸钾和稀盐酸反应生成氯化钾、水和二氧化碳,故试剂中的 Na2CO3 溶液不能用 K2CO3 溶液代替,原因是碳酸钾和氯化钡、氯化钙、稀盐酸反应生成氯化钾,会引入新的杂质。

 阅读快车系列答案
阅读快车系列答案【题目】某班同学用氢氧化钠溶液和稀盐酸进行中和反应实验。
(1)甲同学实验操作如图。
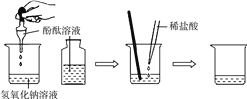
在烧杯中加入约5 mL氢氧化钠溶液,滴入几滴无色酚酞溶液,此时溶液呈________色。
使用胶头滴管吸取液体时,要先按着_______排干净_______,再放入滴瓶中吸取液体。
接着用滴管滴入一定量的稀盐酸,再用玻璃棒搅拌,发现溶液为无色,于是甲同学得出两者恰好中和的结论,反应的化学方程式为________________________________________。
(2)乙同学对甲同学的结论提出了质疑,并对反应后溶液中的溶质成分进行探究。
【实验探究】
反应后溶液中的溶质是什么?
猜想一:只有NaCl。 猜想二:NaCl和HCl。猜想三:NaCl和NaOH。
以上猜想中,你觉得不合理的是______________________。
为了验证另外两种猜想,乙同学设计如下实验方案:
实验操作 | 实验现象 | 实验结论 |
取少量反应后的溶液于试管中滴入Na2CO3溶液 | _______________ | 猜想二成立 |
取少量反应后的溶液于试管中加入锌粒 | _______________ | 猜想一成立 |
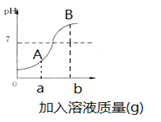
(3)如图是稀HCl和NaOH溶液反应的pH变化曲线,以下说法正确的是(_______)(多选)
A.该反应是稀HCl滴入NaOH溶液中
B.ag是指加入氢氧化钠固体质量
C.A点溶液的溶质为HCl和NaCl
D.检验B点溶液的溶质先滴加足量的Mg(NO3)2,静置后再滴入少量AgNO3
【题目】某班同学用氢氧化钠溶液和稀盐酸进行中和反应实验。
(1)甲同学实验操作如图。

在烧杯中加入约5 mL氢氧化钠溶液,滴入几滴无色酚酞溶液,此时溶液呈________色。
使用胶头滴管吸取液体时,要先按着_______排干净_______,再放入滴瓶中吸取液体。
接着用滴管滴入一定量的稀盐酸,再用玻璃棒搅拌,发现溶液为无色,于是甲同学得出两者恰好中和的结论,反应的化学方程式为________________________________________。
(2)乙同学对甲同学的结论提出了质疑,并对反应后溶液中的溶质成分进行探究。
【实验探究】
反应后溶液中的溶质是什么?
猜想一:只有NaCl。 猜想二:NaCl和HCl。猜想三:NaCl和NaOH。
以上猜想中,你觉得不合理的是______________________。
为了验证另外两种猜想,乙同学设计如下实验方案:
实验操作 | 实验现象 | 实验结论 |
取少量反应后的溶液于试管中滴入Na2CO3溶液 | _______________ | 猜想二成立 |
取少量反应后的溶液于试管中加入锌粒 | _______________ | 猜想一成立 |
(3)如图是稀HCl和NaOH溶液反应的pH变化曲线,以下说法正确的是(_______)(多选)
A.该反应是稀HCl滴入NaOH溶液中
B.ag是指加入氢氧化钠固体质量
C.A点溶液的溶质为HCl和NaCl
D.检验B点溶液的溶质先滴加足量的Mg(NO3)2,静置后再滴入少量AgNO3

【题目】黄铜在日常生活中应用广泛,如许多电子元件、家用龙头等,为了测定某黄铜(合金中仅含铜、锌)中铜的含量。某兴趣小组称取25g黄铜粉末于烧杯中,将100g稀硫酸分四次加入,充分反应后,测得实验数据如下表:
次数 | 第1次 | 第2次 | 第3次 | 第4次 |
加入稀硫酸的质量(g) | 25 | 25 | 25 | 25 |
烧杯中剩余物的质量(g) | 49.88 | 74.76. | 99.70 | 124.70 |
(1)第1次反应生成的氢气的质量 。
(2)该黄铜粉末的中铜的质量分数是多少?
(3)第3次实验后所得溶液中的溶质是(写化学式)?