题目内容
【题目】如图是探究铁锈蚀条件的装置。调节L端与R端的液面高度一致,塞紧木塞,一周后观察。下列推断错误的是( )
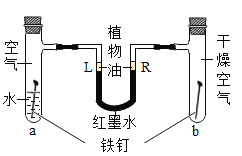
A.b管中铁钉不会锈蚀
B.L端与R端液面高度仍然保持一致
C.该实验说明铁锈蚀与空气、水有关
D.若将a管中的水改为食盐水能加快铁的锈蚀
【答案】B
【解析】
钢铁制品同时接触氧气和水会生锈,食盐等物质会加快铁的锈蚀。
A、b管中铁钉没有和水接触,不会锈蚀,推理正确,不符合题意;
B、a试管中铁生锈消耗氧气,压强小于b试管,L端液面高于R端液面,推理错误,符合题意;
C、a试管中铁生锈,b试管铁没有生锈,说明铁锈蚀与空气、水有关,推理正确,不符合题意
D、若将a管中的水改为食盐水能加快铁的锈蚀,推理正确,不符合题意。
故选B。

【题目】化学兴趣小组的同学发现有一瓶氢氧化钠溶液没有塞橡皮塞,在老师指导下,开展了以下探究:
(提出问题1)该氢氧化钠溶液是否变质了呢?
(实验探究1)
实验操作 | 实验现象 | 实验结论 |
取少量该溶液于试管中,向溶液中滴加稀盐酸,并不断振荡。 | 有气泡冒出。 | 氢氧化钠溶液一定变质了。 |
(提出问题2)该氢氧化钠溶液是全部变质还是部分变质呢?
(猜想与假设)猜想1:氢氧化钠溶液部分变质。猜想2:氢氧化钠溶液全部变质。
(查阅资料)(1)氯化钙溶液呈中性。
(2)氯化钙溶液能与碳酸钠溶液反应:CaCl2+Na2CO3=CaCO3↓+2NaCl
(实验探究2)
实验步骤 | 实验现象 | 实验结论 |
(1)取少量该溶液于试管中,向溶液中滴加过量的氯化钙溶液,并不断振荡。 | 有________生成。 | 说明原溶液中一定有碳酸钠。 |
(2)取步骤(1)试管中的少量上层清液,滴加酚酞溶液。 | 溶液变红色。 | 说明原溶液中一定有_________。 |
(实验结论)该氢氧化钠溶液___________(填“部分”或“全部”)变质。
(反思与评价)
(1)氢氧化钠溶液露置于空气中容易变质,发生反应的化学方程式是_______________。
(2)在上述(实验探究2)中,小明提出可用氢氧化钙溶液代替氯化钙溶液,你认为该方案____(填“可行”或“不可行”)。
(理解与应用)氢氧化钠溶液容易变质,必须密封保存。实验室必须密封保存的药品还有很多,试另举一例:_________________________________________。
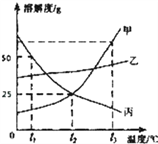
【题目】硫酸锂(Li2SO4)和硝酸钾在不同温度时的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 30 | 40 | |
溶解 度/g | Li2SO4 | 36.1 | 35.4 | 34.8 | 34.3 | 33.9 |
KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | |
请回答下列问题:

(1)依据溶解度表,绘制溶解度曲线如图所示,其中能表示Li2SO4溶解度曲线的是_______(填“甲”或“乙”)。
(2)Li2SO4和KNO3在某一温度时具有相同的溶解度x,则x的范围是_________________。
(3)40℃时,有含少量Li2SO4的KNO3饱和溶液,欲从中提纯KNO3晶体,方法是________________。
(4)将10℃时两种物质的饱和溶液分别升温至30℃,所得Li2SO4溶液中溶质的质量分数__________(填“>”、“<”或“=”)KNO3溶液中溶质的质量分数。
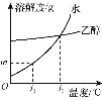
(5)如图所示,20℃时,将盛有饱和Li2SO4溶液的试管放入盛水的烧杯中,向烧杯的水中加入某物质后,试管内有晶体析出。则加入的物质可以是______(填字母序号)。
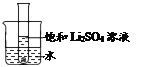
①浓硫酸 ②冰块 ③生石灰固体 ④硝酸铵固体 ⑤氢氧化钠固体
A.②④ B.①③⑤ C.③④ D.①②⑤
【题目】元素周期表是学习化学的重要工具。下表是元素周期表的一部分,请依据此表回答有关问题。
第一周期 | 1 H 1.008 | 2 He 4.003 | ||||||
第二周期 | 3 Li 6.941 | 4 Be 9.012 | 5 B 10.81 | 6 C 12.01 | 7 N 14.01 | 8 O 16.00 | 9 F 19.00 | 10 Ne 20.18 |
第三周期 | 11 Na 22.99 | 12 Mg 24.31 | 13 Al 26.98 | 14 Si 28.09 | 15 P 30.97 | 16 S 32.06 | 17 Cl 35.45 | 18 Ar 39.95 |
(1)第二周期中,铍(Be)元素的相对原子质量为_____。第3周期中,属于金属元素的有_____(填元素名称)。
(2)氧元素的原子结构示意图为: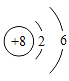 , 第3周期中某元素与氧元素的化学性质相似,该元素的原子结构示意图为:
, 第3周期中某元素与氧元素的化学性质相似,该元素的原子结构示意图为: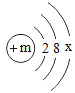 ,则x=_____,m=_____。
,则x=_____,m=_____。
(3)请在原子序数分别为1、8、11、17的四种元素中,选择适当的元素组成物质,这些物质之间能发生中和反应的化学方程式为_____。请选1、6、8、11用其中的元素写出符合要求的化学式一个:
①常温下为气态的非金属氧化物_____。
②由三种元素组成的碱_____。
③由四种元素组成的盐_____。
④能用于实验室制O2,且原子个数比为1:1的物质_____。
【题目】学校研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200 g,平均分成4份进行实验,结果如下:
实 验 | 一 | 二 | 三 | 四 |
加入样品的质量/g | 5 | 10 | 15 | 20 |
生成CO2的质量/g | 1.76 | m | 4.4 | 4.4 |
(1)上表中m的数值是_____ ;
(2)反应中矿石有剩余是第_____次实验;
(3)这种石灰石矿中碳酸钙的质量分数是_____;
(4)稀盐酸中溶质的质量分数是多少?_____