��Ŀ����
����Ŀ��ʵ���������ó���V�ܶԿα�ʵ����иĽ���
��1��̼������ȷֽ⼰�������
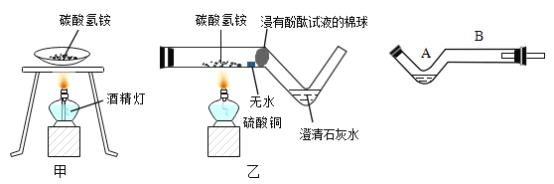
����ʵ������У��ɹ۲쵽̼����粒�����ʧ����ˮ����ͭ���������ϣ���ˮ����ͭ�ʰ�ɫ����ˮ�����ɫ�������з�̪��Һ�������졢����ʯ��ˮ����ǡ�����ʵ��������֪��̼��������ȷֽ����ɰ�����ˮ��________________________��
�ڶԱȼף�����ʵ����̣�����˵���������_____________��
A��ʵ�������ϴ���Ⱦ��ʵ�����û����ʵ�黷��
B��ʵ�������������ʧ������˵��̼��������ȷֽ�
C��ʵ���������ͬѧ�Ƿ�����������ʧ����ԭ��
��2��̽����������
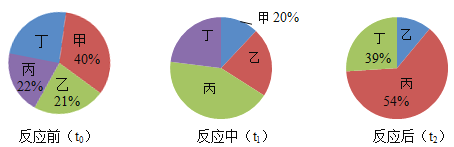
�����װ����ʾ������B���Ž���ɫ����Һ�ij�ֽ������סV������A�����Լ�X���۲쵽B����ɫ��ֽ����죬���Լ�X������________________��
������ȡһ��ͬ��V�β����ܣ�����ͬ��ʵ��ҩƷ����Ʒ������A���Լ��ȣ��ڸ��̵�ʱ���ڿɹ۲쵽������������۽ǶȽ���__________________________________��
���𰸡�CO2���������̼�� B Ũ��ˮ �¶����ߣ����˶��ٶȼӿ�
��������
��1�����ɡ�����ʯ��ˮ����ǡ���֪��������CO2���������̼����
��A����ʵ�����ɵ�����ȫ����ɢ�������У���Ⱦ����������ʵ��װ����Է�գ�����̪��Һ������ʯ��ˮ���պ���ɢ�������е�������Խ��٣���˼�ʵ�鲻����ʵ�黷������A��ȷ��
B��ֻ���ݼ�ʵ�顰������ʧ����һ��������֤̼����立����˷ֽ⣬Ҳ������̼������������µ���ʧ����B����
C���۲쵽��ˮ����ͭ������˵����Ӧ������ˮ�����з�̪��Һ�������죬˵����Ӧ�����˰���������ʯ��ˮ����ǣ�˵����Ӧ�����˶�����̼�������ʵ��������ѧ��������������ʧ����ԭ��C��ȷ�����B��
��2���ٵ�����ɫ��̪��Һ�ij���ֽ����������죬˵���м��Ե����ʣ������Լ�X���лӷ��ԣ����Կ�����Ũ��ˮ��
�������¶�Խ�ߣ������˶���Խ����A���Լ��ȣ��ڸ��̵�ʱ���ڿɹ۲쵽����˵���¶����ߣ����˶��ٶȼӿ졣

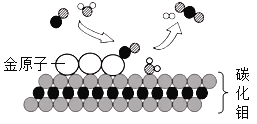
����Ŀ��ij������Ϊ�ۺ�����FeSO4����������¹������̣�
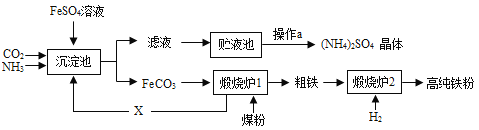
����¯1�з����IJ��ֻ�ѧ��Ӧ�У�FeCO3![]() FeO + CO2����C +CO2
FeO + CO2����C +CO2![]() 2CO
2CO
��1��ú�ۡ�H2������Ҫ�Ļ���ԭ��������Ҫ����Դ��úȼ����Ҫ����ѧ��ת��Ϊ________�ܣ�����ȼ�ϵ�ؿ��Խ�________��ת��Ϊ���ܡ�
��2��X����Ļ�ѧʽ��________��ѭ������X���ŵ���_______��
��3�����н����ܴ�FeSO4��Һ���û���Fe����_______��
aCu bZn cAg
��4��ʵ����ģ�����a�Ĺ���������Ũ����________�����˸��
��5�������ʵ��֤��(NH4)2SO4���̬���ʣ�
ʵ�鲽�� | ʵ������ | ʵ����� |
________ | _________ | ��ƷΪ�̬���� |