题目内容
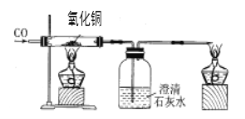
【题目】两种铁的氧化物,其质量分别为0.400g和0.435g,使它们在高温条件下分别与一氧化碳反应,再把生成的二氧化碳全部通人足量的石灰水中,都得到了0.75g沉淀,则这两种氧化物分别是( )
A. FeO和Fe2O3 B. FeO和Fe3O4 C. Fe2O3和Fe3O4 D. Fe3O4和Fe2O3
【答案】C
【解析】
铁的氧化物在高温条件下与一氧化碳反应,生成的二氧化碳与足量的石灰水反应,反应是分步进行的,根据反应的方程式,找出反应的关系式,再利用关系式进行计算,判断出氧化物。
设铁的是氧化物是FexOy。
由FexOy+yCO![]() XFe+yCO2CO2+Ca(OH)2═CaCO3↓+2H2O
XFe+yCO2CO2+Ca(OH)2═CaCO3↓+2H2O
得出:FexOy~yCaCO3
当铁的氧化物是0.400g时
则 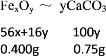
![]()
解得:![]() =
=![]()
所以铁的氧化物是Fe2O3;
当铁的氧化物是0.435g时
则 ![]()
![]()
解得:![]() =
=![]()
所以 铁的氧化物是Fe3O4。故选C。

练习册系列答案
相关题目