题目内容
【题目】(1)镁条具有抗腐蚀性,是因为表面生成了一层氧化物膜,化学实验小组同学为研究镁条表面氧化程度,将3.2g镁条放入一定浓度的稀盐酸中充分反应,测得产生的气体质量与稀盐酸的质量关系如图所示(假设镁条除有MgO外,不含其他杂质)。
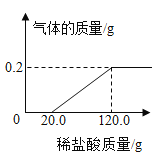
(1)生成氢气的质量为________g。
(2)该镁条中MgO的质量分数为?。
(3)所用稀盐酸中溶质的质量分数为多少?(写出计算过程)
【答案】0.2g;25%;7.3%
【解析】
由图可知生成的氢气的质量为0.2g,参加反应盐酸的质量=120.0g-20.0g=100g;
设生成0.2g氢气需要镁的质量为x,所用稀盐酸中溶质的质量分数为y,
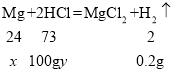
![]() x=2.4g,
x=2.4g,
![]() y=7.3%,
y=7.3%,
镁条中MgO的质量分数=![]() ×100%=25%。
×100%=25%。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】(1)某物质R完全燃烧的化学方程式为:2R+3O2![]() 2CO2+4H2O,R的相对分子质量等于__。R中碳、氢两种元素质量比等于__。__gR中氢元素质量和18g水氢元素质量相等。
2CO2+4H2O,R的相对分子质量等于__。R中碳、氢两种元素质量比等于__。__gR中氢元素质量和18g水氢元素质量相等。
(2)在一密闭容器内加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,反应前后各物质的质量变化见下表。下列说法中不正确的是_____。
物质 | 甲 | 乙 | 丙 | 丁 |
反应前物质质量/g | 8 | 32 | 5 | 4 |
反应后物质质量/g | 16 | 4 | x | 24 |
A 该反应为分解反应
B 甲、乙两种物质间参加反应的质量比为1:4
C 丙可能为该反应的催化剂
D 乙、丁两种物质间反应的质量比为7:5