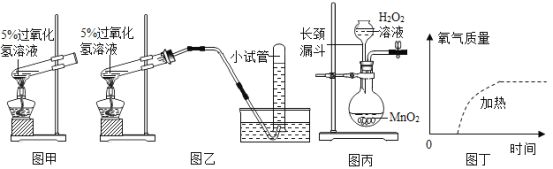
题目内容
【题目】下列说法正确的是( )
A.根据质量守恒定律,2gH2跟8gO2完全反应,可得到10gH2O
B.用含Fe2O385%的赤铁矿160t,理论上可生产100t含杂质4. 8%的生铁
C.各取10g镁粉和锌粉,分别与足量的盐酸完全反应,镁粉产生的H2多,说明镁的金属活动性比锌强
D.将l0gCuSO4·5H2O与90gH2O混合,固体完全溶解,可得100g溶质的质量分数为10%的CuSO4溶液
【答案】B
【解析】
A、氢气和氧气反应的化学方程式为:![]() ,在此反应中氢气、氧气和水的质量关系4:32:36=1:8:9,则1gH2能与8gO2完全反应生成9g水,反应后氢气有剩余,错误;
,在此反应中氢气、氧气和水的质量关系4:32:36=1:8:9,则1gH2能与8gO2完全反应生成9g水,反应后氢气有剩余,错误;
B、160t赤铁矿中含氧化铁的质量为:160t×85%=136t。
设136t氧化铁理论上可以炼出铁的质量为x。

![]()
x=95.2t
可炼得含杂质4. 8%生铁的质量为:95.2t÷(1-4.8%)=100,正确;
C、金属与酸反应,产生气体的多少与金属的活动性没有关系,错误;
D、l0gCuSO4·5H2O中CuSO4的质量为:10g×![]() ×100%=6.4g。与90gH2O混合,固体完全溶解,可得100g溶质的质量分数为:
×100%=6.4g。与90gH2O混合,固体完全溶解,可得100g溶质的质量分数为:![]() ×100%=6.4%,错误。
×100%=6.4%,错误。
故选B。

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目