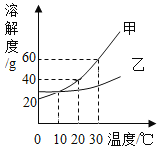
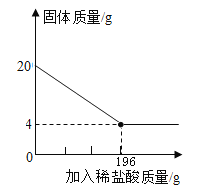
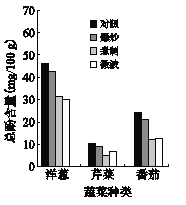
题目内容
【题目】将6g生铁样品加入到盛有100g质量分数为14.7%的过量硫酸的烧杯中(样品中杂质不溶于水,也不与稀硫酸反应),充分反应后过滤,称得滤液的质量为105.8g,试计算:
(1)该生铁样品中铁的质量分数_____(要写出计算步骤,结果保留一位小数)
(2)如果继续加热生铁样品至没有气泡冒出,过滤,将滤液蒸干,可以得到固体多少克?(固体中不含结晶水)
【答案】(1)93.33%;(2)15.2
【解析】
(1)生铁中的铁与稀硫酸反应生成氢气,根据质量守恒定律生成氢气的质量为:6g+100g-105.8g=0.2g。
设:生铁样品中铁的质量为x。
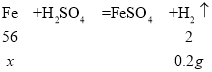
![]() ,解得x=5.6g,
,解得x=5.6g,
该生铁样品中铁的质量分数为:![]() =93.33%
=93.33%
(2)如果继续加热生铁样品至没有气泡冒出,过滤,将滤液蒸干,得到的固体是硫酸亚铁。
设:反应生成硫酸亚铁的质量为y。
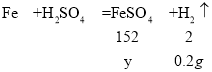
![]() ,解得y=15.2g
,解得y=15.2g

【题目】某品牌可乐由水、白砂糖、焦糖色素(使可乐显黑褐色)、磷酸(H3PO4)等,按一定比例混合并压入二氧化碳配制而成。某同学为了探究可乐的成分及其含量,进行如下实验。
实验一 可乐中二氧化碳的定性检验
(1)请完成下表:
实验步骤 | 实验现象 | 结论 |
打开一塑料瓶装可乐,塞上带导管的橡胶塞,把导管插入 (填化学式)溶液中 | 观察到 | 可乐中含有二氧化碳 |
实验二 可乐中磷酸的定量测定
测定过程如下:
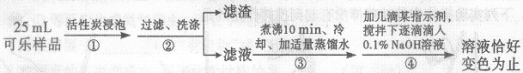
(2)步骤①用活性炭浸泡的目的是 。
(3)步骤③煮沸10分钟的目的是除尽滤液中的 。
(4)已知步骤④反应的化学方程式为H3PO4+NaOH=NaH2PO4+H2O,测得共消耗0.1%的NaOH溶液20g,忽略可乐中其它成分对测定结果的影响,计算可乐中磷酸的含量(以g/L为单位。相对分子质量:H3PO4—98;NaOH—40),写出计算过程。
(5)如果步骤②缺少洗涤,则测定结果 (填“偏高”“不变”或“偏低”)。