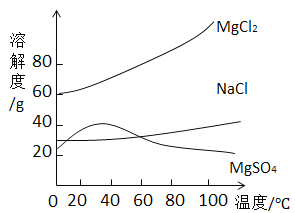
题目内容
【题目】小明同学在做铝和稀盐酸反应时无意中加入几滴硫酸铜溶液,发现铝片表面产生气泡速率明显增快,对此他产生了兴趣。
(提出问题)硫酸铜溶液是不是此反应的催化剂?硫酸铜溶液的体积对此实验有影响吗?
(设计并实验)室温下,小明将过量、表面积相同已打磨的铝片分别加入到6份30mL10%稀盐酸中,并在每份中加入不同体积的硫酸铜饱和溶液,记录获得相同体积氢气的时间,从而确定产生氢气的速率。
实验混合溶液 | 1 | 2 | 3 | 4 | 5 | 6 |
饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | 10 | 20 |
水/mL | 20 | 19.5 | 17.5 | V | 10 | 0 |
(1)上述表格中V=______________。
(2)写出铝和稀盐酸反应的化学方程式:______________。
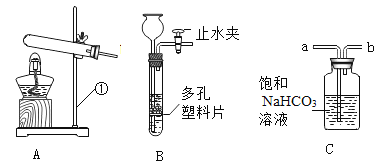
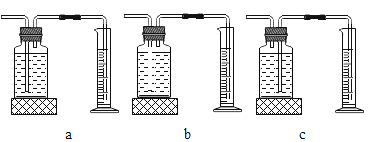
(3)定量收集氢气体积可用如图________(填写字母序号)装置。
(实验现象)随着硫酸铜溶液体积的增加,产生氢气的速率先加快后明显减慢,且铝片表面附着的红色物质逐渐增加。
(结论与解释)
(4)随着硫酸铜溶液体积的增加,反应速率明显变慢可能的原因是___
(5)根据实验现象小明认为硫酸铜溶液不是此反应的催化剂,其原因是___
(实验反思)加速铝和稀盐酸反应速率还可以采取的措施是___(写出一点)
(注意:若正确回答下列各题奖励4分,化学总分不超过60分)
(实验拓展)根据上述实验,小明认为是盐中的金属离子影响了铝和稀盐酸的反应速率;为了研究不同金属离子对反应的影响,小明同学继续实验,取过量表面积相同的铝片和30mL10%稀盐酸混合后加入不同的盐溶液,实验现象如表(加号越多,代表反应速率越快):
实验1 | 实验2 | 实验3 | 实验4 | 实验5 | |
加入试剂0.5mL | 水 | 5%NaCl溶液 | 5%Mg2(NO)3溶液 | 5%FeSO4溶液 | 5%CuSO4溶液 |
产生气泡速率 | + | + | + | ++ | +++ |
(6)如表中,用水进行实验的目的是_________;
(7)上述实验设计存有缺陷,该缺陷是;改进实验后,仍符合上表中的实验现象,可得到的结论是:①______________;②______________.
【答案】15 2Al+6HCl=2AlCl3+3H2↑ c 部分铝和硫酸铜发生了置换反应 硫酸铜质量发生改变,且与铝发生了反应 增大稀盐酸的浓度,升高温度 进行对比 Na+ Mg2+对实验效果没有明显改变 Fe2+ Cu2+能加快铝和稀盐酸的反应速率,且Cu2+的效果更
【解析】
本题主要考察通过设计实验探究物质发生反应快慢的影响因素
(1)饱和硫酸铜溶液与水的体积之和等于20mL,实验4中,饱和硫酸铜溶液5mL,则水的体积是20-5=15mL
(2)铝和稀盐酸反应原理:2Al+6HCl=2AlCl3+3H2↑
(3)排水法收集气体,并测量气体体积,需要“短管进,长管出”选择c装置
(4)铝比铜活泼,部分铝和硫酸铜发生了置换反应,随着硫酸铜溶液的体积增加,反应速率明显变慢
(5)硫酸铜溶液不是催化剂的原因:硫酸铜溶液质量发生改变,且硫酸铜与铝发生化学反应
(6)加速铝和稀盐酸反应速率还可以采取的措施是:1提高温度2增大稀盐酸的浓度
(7)用水进行试验的目的是:进行对比参照
(8)试验现象可以得到的结论:Na+ Mg2+对实验效果没有明显改变
(9)试验现象可以得到的结论:Fe2+ Cu2+能加快铝和稀盐酸的反应速率,且Cu2+的效果更好

【题目】氢氧化钠和氢氧化钙是两种常见的碱。李红同学将两种碱的溶液分别装人试管A 、B 中,并进行了如下图所示的三组实验。
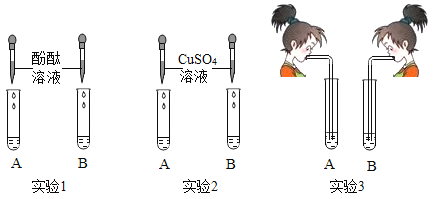
(1)实验l 中,两支试管的溶液都变成___________色。
(2)实验2中,若B 盛装的是NaOH 溶液,发生反应的化学方程式为______________,该反应的墓本类型是_______________反应。
(3)实验3中,李红同学向两支试管吹气,A 中有白色沉淀生成,发生反应的化学方程式为_______________________。B 中无现象,为了探究吹气后B 中溶质的成分,李红进行了如下探究。
提出猜想:
猜想1 :溶质只有氢氧化钠
猜想2 :溶质只有碳酸钠
猜想3 :溶质有氢氧化钠和碳酸钠
……
实验和结论:
实验 | 实验现象 | 结论 |
取B 中少量溶液,加人澄清石灰水至不再产生沉淀为止,过滤后取上层清液,向其中加几滴酚酞试液。 | 产生白色沉淀溶液呈现红色 | 猜想3成立 |
反思与评价:
老师评价李红得出的结论不正确,是因为猜想___________________(填数字)也会产生相同的现象。如果要验证“猜想3成立”,必须要换试剂,将______溶液换成________溶液。