题目内容
【题目】已知白色固体可能由CuSO4、CaCO3、BaCl2、Na2SO4、NaOH中的两种或两种以上的物质混合而成,某化学兴趣小组的同学欲探究该白色固体的组成并测定某稀硫酸的溶质质量分数,他们进行了如下实验:
(1)取少量白色固体样品,向其中加入足量的水,充分搅拌后过滤,得到白色沉淀和无色滤液,向滤液中滴加酚酞试液,无明显现象。则原白色粉末中一定不含有____。
(2)取实验(1)滤出的白色沉淀,向其中加入足量的盐酸,沉淀部分溶解,并产生无色气体。则原白色粉末中一定含有 ______。
(3)为测定某稀硫酸的溶质质量分数,他们设计了如下实验方案:
![]()

第②步实验中生成沉淀的质量与加入NaOH溶液的质量关系如图所示,当加入agNaOH溶液时,与NaOH发生反应的物质是___,加入bgNaOH溶液时产生的沉淀是___;字母m、a、b之间的关系为:b=___;若b=160,稀硫酸的溶质质量分数为 ___(写出过程)。
【答案】CuSO4、NaOH CaCO3、BaCl2、Na2SO4 H2SO4 Cu(OH)2 a+10m 9.8%
【解析】
硫酸铜在溶液中显蓝色,氢氧化钠能使酚酞变红色,氯化钡和硫酸钠反应会生成不溶于酸的硫酸钡沉淀,碳酸钙难溶于水,会与酸反应生成二氧化碳气体。
(1)取少量白色固体样品,向其中加入足量的水,充分搅拌后过滤,得到白色沉淀和无色滤液,向滤液中滴加酚酞试液,无明显现象,所以原白色粉末中一定不含有氢氧化钠、硫酸铜;
(2)取实验(1)滤出的白色沉淀,向其中加入足量的盐酸,沉淀部分溶解,并产生无色气体,说明沉淀为碳酸钙和硫酸钡,所以原白色粉末中一定含有:碳酸钙、氯化钡、硫酸钠;
(3)当加入agNaOH溶液时,沉淀的质量没有开始增加,所以与NaOH发生反应的物质是稀硫酸,加入bg NaOH溶液时产生的沉淀是氢氧化铜;
由图象可以看出,与硫酸铜反应的氢氧化钠的质量为(b-a)g,所以
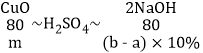
![]()
b=10m+a,
依据元素守恒,硫酸和氧化铜反应生成硫酸铜,以及剩余的硫酸都会与氢氧化钠反应,所以
稀硫酸的溶质质量分数为x
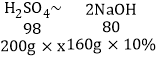
![]()
解得 x=9.8%
答:稀硫酸的溶质质量分数为9.8%。

 通城学典默写能手系列答案
通城学典默写能手系列答案