题目内容
【题目】某小组同学利用如图所示装置探究铁生锈的条件。
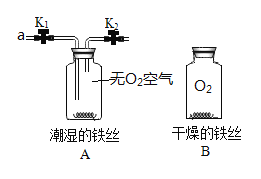
(1)要证明铁生锈与氧气有关,需要进行的实验操作为__________。
(2)实验中能说明铁生锈与水有关的实验现象是________。
(3)充分反应后,将装置A、B中分别注入少量稀盐酸,两个广口瓶中现象的不同点是:_______,由此也可以证明铁丝生锈情况。A中反应的化学方程式是______。
【答案】对A中铁丝观察一段时间后,打开止水夹K1、K2,通入氧气后关闭止水夹K1、K2,继续观察 通一段时间氧气后A中铁丝表面生成红色固体而B中铁丝没有明显变化 A中铁丝表面红色固体减少,溶液由无色变为黄色,B中铁丝表面有气泡产生溶液由无色变为浅绿色 Fe2O3+6HCl=2FeCl3+3H2O
【解析】
(1)要证明铁生锈与氧气有关,只要给A中通入氧气即可,因此对A中铁丝观察一段时间后,打开止水夹K1、K2,通入氧气后关闭止水夹K1、K2,继续观察;
(2)在B中铁丝与氧气接触没有生锈,因此实验中能说明铁生锈与水有关的实验现象是通一段时间氧气后A中铁丝表面生成红色固体而B中铁丝没有明显变化;
(3)A中铁丝生锈生成氧化铁,通入盐酸后盐酸和氧化铁反应生成氯化铁和水,试验现象为:A中铁丝表面红色固体减少,溶液由无色变为黄色,方程式为:Fe2O3+6HCl=2FeCl3+3H2O
;B中铁丝与稀盐酸反应有气体放出生成氯化亚铁,现象为:铁丝表面有气泡产生溶液由无色变为浅绿色。
故答案为:(1)对A中铁丝观察一段时间后,打开止水夹K1、K2,通入氧气后关闭止水夹K1、K2,继续观察;
(2)通一段时间氧气后A中铁丝表面生成红色固体而B中铁丝没有明显变化;
(3)A中铁丝表面红色固体减少,溶液由无色变为黄色,B中铁丝表面有气泡产生溶液由无色变为浅绿色;(4)Fe2O3+6HCl=2FeCl3+3H2O。

 阅读快车系列答案
阅读快车系列答案