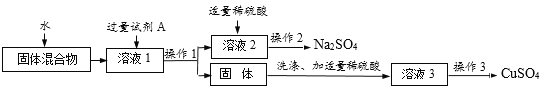
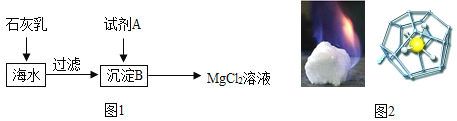
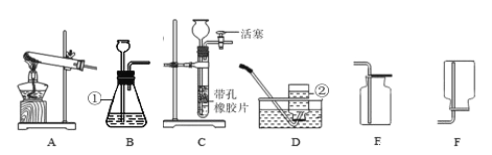
题目内容
【题目】将29.1g由NaCl和BaCl2组成的固体混合物溶解于94.2g水中,向所得溶液中滴加质量分数为14.2%的Na2SO4溶液。如图是所加Na2SO4溶液质量与生成沉淀质量的关系图,计算
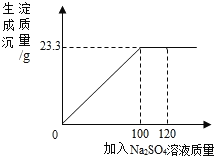
(1)生成23.3g沉淀时,滴加的Na2SO4溶液中含Na2SO4的质量是_____g。
(2)恰好完全反应时所得溶液的溶质质量分数________。
【答案】14.2g 10%
【解析】
1)生成23.3g沉淀时,滴加的Na2SO4溶液中含Na2SO4的质量为m
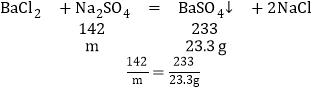
m=14.2g;
故答案为:14.2g;
(2)设原混合物中含有BaCl2的质量为x,反应生成NaCl的质量为y
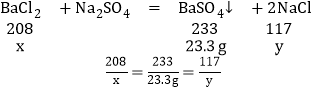
x=20.8g;
y=11.7g;
溶质氯化钠的质量:(29.1g﹣20.8g)+11.7g=20g
溶液的质量:29.1g+94.2g+100g﹣23.3g=200g
溶液中溶质的质量分数=![]() ;
;
答:恰好完全反应时所得溶液的溶质质量分数为10%。

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
【题目】某研究性学习小组欲测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品 5g,把 40g 稀盐酸分四次加入,实验过程所得数据如下表(已知石灰石样品中含有的杂质 不溶于水,也不与稀盐酸反应)。根据实验数据计算:
实验次数 | 1 | 2 | 3 | 4 |
加入稀盐酸的质量/g | 10 | 10 | 105 | 10 |
剩余固体的质量/g | 3.0 | 1.00 | 0.75 | 0.75 |
(1)石灰石样品中碳酸钙的质量分数为_____________ 。
(2)求原 40 g 稀盐酸中溶质质量分数(要求书写计算过程))____________。