题目内容
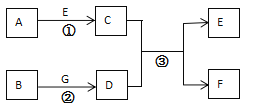
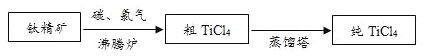
【题目】由钛精矿(主要成分为TiO2)制备纯TiCl4的流程示意图如图:
已知:TiCl4中钛元素的化合价为+4。
(1)流程中,蒸馏塔的作用是_____。
(2)沸腾炉中发生了反应![]() ,其中化合价发生改变的元素是_____。
,其中化合价发生改变的元素是_____。
【答案】分离提纯TiCl4 Cl和O
【解析】
(1)室温下,四氯化钛为无色液体,流程中,蒸馏塔中加热,导致四氯化钛转化为气体而实现和杂质的分离,然后冷凝后为液体,从而达到提纯的目的,所以蒸馏塔的作用是分离提纯TiCl4。
(2)沸腾炉中发生了反应TiO2+2Cl2![]() TiCl4+O2,其中氯元素由反应前的0价变成反应后的﹣1价,而氧元素由反应前的﹣2价变为生成物中的0价,Ti反应前后化合价均为+4价,所以化合价发生改变的元素是Cl和O。
TiCl4+O2,其中氯元素由反应前的0价变成反应后的﹣1价,而氧元素由反应前的﹣2价变为生成物中的0价,Ti反应前后化合价均为+4价,所以化合价发生改变的元素是Cl和O。

 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案【题目】实验设计是化学实验的重要环节.请根据下列实验要求回答相关问题:
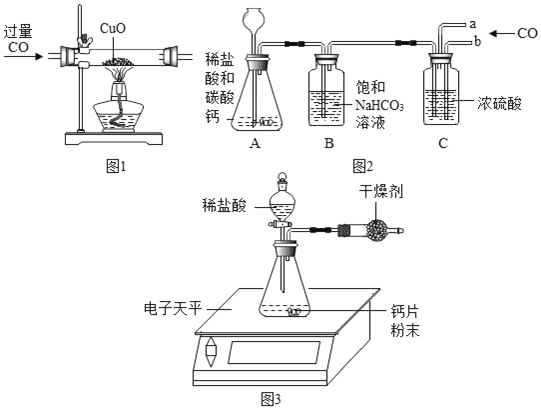
(活动与探究一)收集不同体积比例的二氧化碳和一氧化碳混合气体.
方案一:如图1所示
(1)请写出硬质玻璃管中发生反应的化学方程式_____;
(2)该实验能获得二氧化碳和一氧化碳混合气体,其原因是_____;
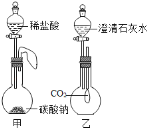
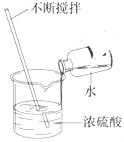
方案二:根据如图2装置所示请回答下列问题:(提示:饱和NaHCO3溶液的作用是除去HCl气体,部分夹持装置及导管已略去)
(1)写出装置A中发生反应的化学方程式:_____.
(2)CO气体应由_____(填“a”或“b”)通入,在C中混合后,由另一导管导出.
(3)装置C中浓硫酸的两点主要作用:
①干燥气体,减少实验误差;②_____.
测定某钙片(主要成分CaCO3)中碳酸钙的质量分数,用如图3装置进行如下实验:①取研碎后的钙片4克,倒入气密性良好的锥形瓶中,然后在分液漏斗中加入过量的稀盐酸,置于电子天平上测出装置总质量.②打开活塞,滴入足量稀盐酸后关闭活塞,待气泡不再冒出时,测出反应后装置总质量.③整理相关数据如下表
反应前总质量(克) | 275.58 |
反应后总质量(克) | 274.92 |
(1)小明结合表中数据,计算该钙片中碳酸钙的质量分数.(其它成分不与盐酸反应).
(2)该实验中,如果装置中不加固态干燥剂(干燥剂的作用:吸水但不吸二氧化碳),则最终所算得钙片中碳酸钙的质量将_____(填“偏大”“偏小”或“不变”).