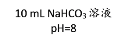题目内容
【题目】化学变化是化学学科最具特色的内容。而质量守恒定律是认识化学变化的一个基本规律。
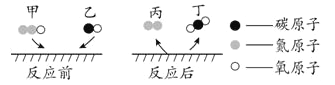
(l)下面是电解水的微观示意图,请回答:

根据示意图说明:在化学反应前后,质量守恒的原因_____。
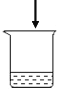
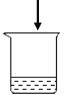
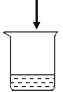
(2)如图所示的甲、乙两个装置(气密性良好),从分液漏斗中加入液体,一段时间后两装置中的气球都胀大(忽略液体体积对气球体积的影响)。精确称量发现:两个实验反应后质量均与反应前数值不相等。
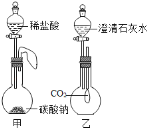
①两个反应_____(填“遵守”或“不遵守”)质量守恒定律;
②请解释甲中称取反应后的质量与反应前质量不相等的原因是_____;
③请解释乙装置中气球胀大的原因_____。
【答案】化学反应前后,原子种类、总个数、质量都不变 遵守 气球膨胀受到向上的浮力 二氧化碳被澄清石灰水吸收后导致瓶内气压减小
【解析】
(l)根据示意图可知:在化学反应前后,质量守恒的原因是化学反应前后,原子种类、总个数、质量都不变;
(2)①两个反应遵守质量守恒定律;
②甲中称取反应后的质量与反应前质量不相等的原因是气球膨胀受到向上的浮力;
③乙装置中气球胀大的原因是二氧化碳被澄清石灰水吸收后导致瓶内气压减小。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案【题目】兴趣小组同学尝试用红心火龙果汁、发酵粉和面粉制作“紫红色花卷”。蒸熟后,却发现花卷变成了黄色。他们对此进行了探究。

(查阅资料)
①红心火龙果汁含天然色素,呈紫红色,受热易分解。②发酵粉主要成分是碳酸氢钠,受热分解生成碳酸钠、水和二氧化碳
(猜想与假设)
Ⅰ.紫红色花卷变黄与温度升高有关
Ⅱ.紫红色花卷变黄与发酵粉有关
实验1:探究影响紫红色花卷变黄的因素。
序号 | 1-1 | 1-2 | 1-3 | 1-4 |
用品 | 红心火龙果汁、 面粉 | 红心火龙果汁、 面粉 | 红心火龙果汁、 面粉、发酵粉 | 红心火龙果汁、 面粉、发酵粉 |
操作 | 加热 | 不加热 | 加热 | 不加热 |
现象 | 从紫红变红棕色 | 仍为紫红色 | 从紫红变黄色 | 仍为紫红色 |
(1)碳酸氢钠的俗称是__________。
(2)实验1-1出现“从紫红色变红棕色”的原因是________。
(3)综合实验1,能得出的结论是__________。
实验2:继续探究实验1-3中花卷变黄的原因。
序号 | 2-1 | 2-2 | 2-3 |
实验过程 |
红心火龙果汁 |
红心火龙果汁 |
红心火龙果汁 |
现象 | 颜色无明显变化 | 一段时间后变黄色 | 较短时间后变黄色 |
(4)写出碳酸氢钠受热分解的化学方程式:_________。
(5)综合实验2,能得出的结论是_________。
(6)下列关于制作紫红色花卷的说法中,正确的是__________(填字母序号)。
A 当使用火龙果汁染色时,通过控制发酵粉的用量可以蒸出紫红色花卷
B 换用受热不易分解的紫红色果汁或紫薯汁,有可能蒸出紫红色花卷
C 酸碱性可能会影响蒸出花卷的颜色
【题目】如图所示,烧瓶内盛有x气体,若挤压滴管的胶头a,使液体y进入烧瓶中,振荡烧瓶,并倒放在铁架台上,将导管伸入滴有z的水中,打开弹簧夹b,可见烧杯中的液体如喷泉一样喷入烧瓶中,并出现颜色的改变.则x、y、z可能是( )
选项 | |||
A | O2 | H2SO4 | 紫色石蕊试液 |
B | CO2 | H2O | 无色酚酞试液 |
C | CO | Ca(OH)2 | 紫色石蕊试液 |
D | CO2 | NaOH | 无色酚酞试液 |

A.A B.B C.C D.D
【题目】化学研究小组在开展了“过氧化氢制取氧气的反应中二氧化锰的作用”之后,又进行了“寻找新的催化剂”的探究实验。
(提出问题1)寻找“氧化铁能否用于过氧化氢溶液分解的催化剂”的证据?如果能,它的催化效果如何?(实验设计1)
实 验 | 现 象 |
Ⅰ、分别量取5毫升5%的过氧化氢溶液于A、B两支试管中,向A中加入a克氧化铁粉末,并分别在A、B两支试管中伸入带火星的木条,观察现象, | A试管中产生气泡,带火星的木条复燃,B试管中无明显现象 |
Ⅱ、将“实验Ⅰ”中A试管的剩余物质分离,将所得固体进行洗涤、干燥、称量 | 所得固体质量为 ______ 克 |
Ⅲ、将“实验Ⅱ” ______ | ______ |
Ⅳ、分别量取5毫升5%的过氧化氢溶液放入C、D两支试管中,向C试管中加入a克氧化铁粉末,向D试管中加入a克二氧化锰粉末 |
(实验结论)
(1)A中产生的气体是______;
(2)氧化铁可以作过氧化氢分解的催化剂,寻找该结论的证据主要是设计了实验______(选填Ⅰ、Ⅱ、Ⅲ或Ⅳ)展开的。
(实验评价)
(1)设计实验Ⅲ的目的是______;
(2)可以用下列方法作出判断,从而达到实验Ⅳ的设计目的。a、定性判断:观察C、D两支试管中产生气泡的快慢;b、定量判断:______。
(资料信息)过氧化氢分解除了用二氧化锰还可用氧化铜等物质作为催化剂
(提出问题2)氧化铜(黑色粉末)是否也能作氯酸钾分解的催化剂?它是否比二氧化锰效果更好?
(设计实验2)某同学以生成等体积的氧气为标准,设计了下列三组实验
(其它可能影响实验的因素均忽略)。
实验序号 | 氯酸钾质量 | 其他物质质量 | 待测数据 |
① | 1.2克 | X | |
② | 1.2克 | 氧化铜0.5克 | Y |
③ | m | 二氧化锰0.5克 | Z |
(1)写出氯酸钾在二氧化锰的催化作用下发生的反应的化学方程式:______。
(2)上述实验应测量的“待测数据”是指______,从数学描述角度,X、Y、Z在数值上的大小关系是______。
(3)若实验②比实验①的“待测数据”更______(填“大”、“小”、“不确定”),说明氧化铜能加快氧酸钾的分解速率,表中“m”的数值应该为______。
(4)将实验②反应后的固体经过过滤、洗涤、干燥处理后,称量得到0.5克黑色粉末,再将黑色粉末放入______(简述操作)。
(评价设计)
(5)你认为该小组同学设计实验③和实验②对比的目的是______。