题目内容
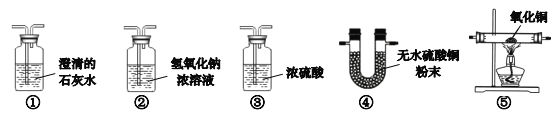
【题目】实验操作是一项重要的技能,以下实验操作中正确的是( )
A. 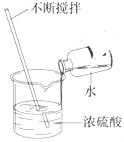 稀释浓硫酸B.
稀释浓硫酸B.  测定溶液的pH
测定溶液的pH
C.  闻气体气味D.
闻气体气味D.  吹灭酒精灯
吹灭酒精灯
【答案】C
【解析】
A、稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,使热量及时扩散出去,一定不能把水注入浓硫酸中,选项错误;
B、用pH试纸测定未知溶液的pH时,正确的操作方法为取一片pH试纸放在玻璃片或白瓷板上,用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH,不能将pH试纸伸入待测液中,以免污染待测液,且不能用手拿试纸,选项错误;
C、闻气体的气味时,应用手在瓶口轻轻的扇动,使极少量的气体飘进鼻孔,不能将鼻子凑到集气瓶口去闻气体的气味,选项正确;
D、使用酒精灯时要注意“两查、两禁、一不可”,禁止用一酒精灯去引燃另一酒精灯,选项错误,故选C。

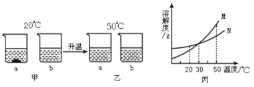
【题目】如图所示,烧瓶内盛有x气体,若挤压滴管的胶头a,使液体y进入烧瓶中,振荡烧瓶,并倒放在铁架台上,将导管伸入滴有z的水中,打开弹簧夹b,可见烧杯中的液体如喷泉一样喷入烧瓶中,并出现颜色的改变.则x、y、z可能是( )
选项 | |||
A | O2 | H2SO4 | 紫色石蕊试液 |
B | CO2 | H2O | 无色酚酞试液 |
C | CO | Ca(OH)2 | 紫色石蕊试液 |
D | CO2 | NaOH | 无色酚酞试液 |

A.A B.B C.C D.D
【题目】小明为研究金属X、Zn、Fe、Cu的活动性顺序,做了如下实验:
(1)将金属X分别放入ZnSO4、FeSO4、CuSO4的溶液中,反应后有无金属析出的情况如下表所示:
溶液种类 | ZnSO4 | FeSO4 | CuSO4 |
加入X后有无金属析出 | 无 | 无 | 有 |
则金属X、Cu和Fe的活动性顺序由强到弱排列为_____。
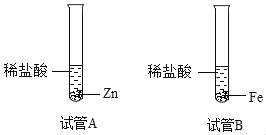
(2)小明继续研究Zn和Fe的活动性强弱,将质量相等的颗粒大小相同的金属Zn和Fe放在少量的相同体积的同种稀盐酸中,如图所示,若出现_____的现象,则Zn的活动性比Fe强;
(3)小军通过将Fe放入CuSO4溶液反应,也可比较出Cu和Fe的活动性强弱,请写出Fe和CuSO4的化学方程式_____。
【题目】化学研究小组在开展了“过氧化氢制取氧气的反应中二氧化锰的作用”之后,又进行了“寻找新的催化剂”的探究实验。
(提出问题1)寻找“氧化铁能否用于过氧化氢溶液分解的催化剂”的证据?如果能,它的催化效果如何?(实验设计1)
实 验 | 现 象 |
Ⅰ、分别量取5毫升5%的过氧化氢溶液于A、B两支试管中,向A中加入a克氧化铁粉末,并分别在A、B两支试管中伸入带火星的木条,观察现象, | A试管中产生气泡,带火星的木条复燃,B试管中无明显现象 |
Ⅱ、将“实验Ⅰ”中A试管的剩余物质分离,将所得固体进行洗涤、干燥、称量 | 所得固体质量为 ______ 克 |
Ⅲ、将“实验Ⅱ” ______ | ______ |
Ⅳ、分别量取5毫升5%的过氧化氢溶液放入C、D两支试管中,向C试管中加入a克氧化铁粉末,向D试管中加入a克二氧化锰粉末 |
(实验结论)
(1)A中产生的气体是______;
(2)氧化铁可以作过氧化氢分解的催化剂,寻找该结论的证据主要是设计了实验______(选填Ⅰ、Ⅱ、Ⅲ或Ⅳ)展开的。
(实验评价)
(1)设计实验Ⅲ的目的是______;
(2)可以用下列方法作出判断,从而达到实验Ⅳ的设计目的。a、定性判断:观察C、D两支试管中产生气泡的快慢;b、定量判断:______。
(资料信息)过氧化氢分解除了用二氧化锰还可用氧化铜等物质作为催化剂
(提出问题2)氧化铜(黑色粉末)是否也能作氯酸钾分解的催化剂?它是否比二氧化锰效果更好?
(设计实验2)某同学以生成等体积的氧气为标准,设计了下列三组实验
(其它可能影响实验的因素均忽略)。
实验序号 | 氯酸钾质量 | 其他物质质量 | 待测数据 |
① | 1.2克 | X | |
② | 1.2克 | 氧化铜0.5克 | Y |
③ | m | 二氧化锰0.5克 | Z |
(1)写出氯酸钾在二氧化锰的催化作用下发生的反应的化学方程式:______。
(2)上述实验应测量的“待测数据”是指______,从数学描述角度,X、Y、Z在数值上的大小关系是______。
(3)若实验②比实验①的“待测数据”更______(填“大”、“小”、“不确定”),说明氧化铜能加快氧酸钾的分解速率,表中“m”的数值应该为______。
(4)将实验②反应后的固体经过过滤、洗涤、干燥处理后,称量得到0.5克黑色粉末,再将黑色粉末放入______(简述操作)。
(评价设计)
(5)你认为该小组同学设计实验③和实验②对比的目的是______。