题目内容
【题目】某小组同学在协助老师整理化学试剂时,发现一瓶标签残缺的无色液体(如图)(温馨提示:标签上的5%表示该混合物中主要成分所占的质量分数).他们对此瓶无色液体是什么产生了兴趣,于是进行了如下探究.
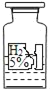
(大胆猜想)猜想一:水 猜想二:稀硫酸 猜想三:过氧化氢溶液
小组同学对标签又进行了仔细的观察、分析,他们一致认为猜想一不合理.理由是:_____.
(设计方案)同学们结合所学知识设计出如下探究方案:
向盛有少量二氧化锰的试管中加入适量的该液体,并将带火星的木条放在试管口.
(实验与事实)按上述方案进行实验,发现有大量气泡产生,带火星的木条复燃.
(结论与解释)(1)以上事实证明猜想_____是正确的;
(2)产生气体的反应可用化学方程式表示为_____.
(反思与评价)(1)在实验中,某同学提出应该先将气体收集,然后用带火星的木条检验,你认为_____(填“有”或“没有”)必要.
(2)为避免在今后的实验中出现标签残缺的情况,在倾倒液体时应注意_____.
(拓展与迁移)根据探究结果,重新贴好标签.标签上化学式中氧元素的化合价为_____价.
【答案】从标签上可知这瓶无色液体属于混合物,而水是纯净物 三 2H2O2![]() 2H2O+O2↑ 没有 标签向着手心 ﹣1
2H2O+O2↑ 没有 标签向着手心 ﹣1
【解析】
[大胆猜想]虽然水的化学式为H2O符合残缺标签中化学式的特点,但标签还标有“5%”字样,说明该瓶内为某种溶液;溶液为混合物,而水为纯净物;根据这些判断对猜想一进行评价;
[结论与解释](1)该液体在二氧化锰催化下分解出能使带火星木条复燃的氧气,可判断液体为过氧化氢溶液;
(2)过氧化氢在二氧化锰催化下,分解可生成水和氧气;据此,写出反应的化学方程式;
[反思与评价](1)检验生成的气体是否为氧气,只需要把带火星的木条伸入管内,木条复燃即可证明气体为氧气,无须进行气体的收集;
(2)为防止试剂瓶上标签被腐蚀,倾倒液体时须标签向着手心;
[拓展与迁移]根据化合物中元素化合价代数和为零,由H元素为+1价计算过氧化氢中O元素的化合价.
[大胆猜想]标签上的5%表示该混合物中主要成分所占的质量分数,因此试剂瓶内液体为溶液,而水为纯净物不属于溶液;所以猜想一液体为水的猜想不正确;
故答案为:从标签上可知这瓶无色液体属于混合物,而水是纯净物;
[结论与解释](1)液体加入二氧化锰分解放出使带火星木条复燃的氧气,因此,液体为过氧化氢溶液,所以猜想三是正确的;
故答案为:三;
(2)过氧化氢在二氧化锰催化下可分解生成水,同时放出气体氧气,因此反应的化学方程式为2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
故答案为:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
5.[反思与评价](1)检验产生气体为氧气时,可用带火星木条伸入试管,木条复燃即可说明产生气体为氧气,不需要进行气体的收集;
故答案为:没有;
(2)倾倒液体药品时,标签向着手心可防止残留液体药品流下而腐蚀标签;
故答案为:标签向着手心;
6.[拓展与迁移]过氧化氢的化学式为H2O2,其中H元素为+1价,设O元素的化合价为x
(+1)×2+x×2=0
解之得x=﹣1
故答案为:﹣1.

 阅读快车系列答案
阅读快车系列答案【题目】小明为研究金属X、Zn、Fe、Cu的活动性顺序,做了如下实验:
(1)将金属X分别放入ZnSO4、FeSO4、CuSO4的溶液中,反应后有无金属析出的情况如下表所示:
溶液种类 | ZnSO4 | FeSO4 | CuSO4 |
加入X后有无金属析出 | 无 | 无 | 有 |
则金属X、Cu和Fe的活动性顺序由强到弱排列为_____。
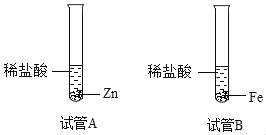
(2)小明继续研究Zn和Fe的活动性强弱,将质量相等的颗粒大小相同的金属Zn和Fe放在少量的相同体积的同种稀盐酸中,如图所示,若出现_____的现象,则Zn的活动性比Fe强;
(3)小军通过将Fe放入CuSO4溶液反应,也可比较出Cu和Fe的活动性强弱,请写出Fe和CuSO4的化学方程式_____。