题目内容
【题目】化学兴趣A组的同学们利用废硫酸液制备K2SO4,设计的流程如下图所示:
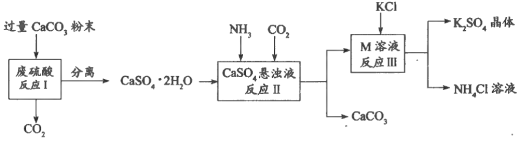
(1)写出反应Ⅰ的化学方程式:___________________________________________。
(2)反应Ⅱ生成了一种可用作氮肥的物质M,M的化学式为_________________。
(3)上述流程中可循环使用的物质有CO2和_____________________(填化学式)。
(4)反应Ⅲ中相关物质在25℃时的溶解度如下表。
物质 |
|
|
|
|
溶解度/g | 34.0 | 11.1 | 37.2 | 19.5 |
反应Ⅲ在常温下(25℃)能实现的原因是___________________________________。
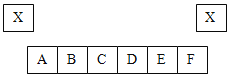
(5)不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的目的是_____________;为了检验此晶体是否洗涤干净,常取最后一次洗涤液于试管中,先加入过量的_____________(选填字母),振荡、静置, 再向上层清液中滴加_____________(选填字母),观察现象即可判断该晶体是否洗涤干净。
A AgNO3溶液 B BaCl2溶液 C Ba(NO3)2溶液
D Ba(OH)2溶液 E NaOH溶液 F KOH溶液
【答案】CaCO3+H2SO4=CaSO4+CO2↑+H2O (NH4)2SO4 CaCO3 25℃时硫酸钾的溶解度小 减少K2SO4的溶解 c a
【解析】
(1)碳酸钙和硫酸反应生成硫酸钙和水和二氧化碳,化学方程式为:CaCO3+H2SO4=CaSO4+CO2↑+H2O;
(2)氨气、二氧化碳和水反应生碳酸铵,碳酸铵再和硫酸钙反应生成碳酸钙和硫酸铵,硫酸铵含有氮元素可做氮肥,故填:(NH4)2SO4;
(3)上述流程中可循环使用的物质有CO2和CaCO3;
(4)硫酸铵和氯化钾反应生成氯化铵和硫酸钾,由于25℃时硫酸钾的溶解度小,故反应Ⅲ在常温下(25℃)能实现,故填:25℃时硫酸钾的溶解度小;
(5)不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的目的是减少K2SO4的溶解;为检验此晶体是否洗涤干净,可取最后一次洗涤液,先加入过量的Ba(NO3)2溶液,振荡、静置,目的是除去硫酸根,再向上层清液中滴加AgNO3溶液,如果没有白色沉淀,说明洗涤干净,故填:减少K2SO4的溶解;c;a。

 智能训练练测考系列答案
智能训练练测考系列答案【题目】为了研究物质的溶解现象,设计并进行了如下实验。
实验 |
① |
② |
③ |
现象 | 固体完全溶解, 形成紫色溶液 | 固体少量溶解, 形成浅黄色溶液 | 固体完全溶解, 形成棕色溶液 |
(1)设计实验①、②的目的是______。
(2)依据实验②、③的现象,可得出的结论是______。