题目内容
【题目】氯化钠和硝酸钾两种固体的溶解度曲线如图所示。下列说法正确的是
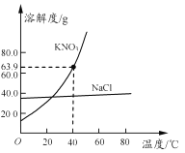
A. 硝酸钾的溶解度大于氯化钠的溶解度
B. 常用降温结晶的方法从氯化钠溶液中获得其晶体
C. 40℃时,将35 g硝酸钾晶体放入50 g水中,充分搅拌后,所得溶液的溶质质量分数为42.0%
D. 将20℃的硝酸钾饱和溶液升温至60℃,溶液的溶质质量分数不变(忽略水分蒸发)
【答案】D
【解析】
A、在比较物质的溶解度时,需要指明温度,故A错误;
B、氯化钠的溶解度受温度变化影响不大,所以常用蒸发结晶的方法从氯化钠溶液中获得其晶体,故B错误;
C、40℃时,硝酸钾的溶解度是63.9g,所以将35g硝酸钾晶体放50g水中,充分搅拌后,所得溶液的溶质质量分数为:![]() ,故错误;
,故错误;
D、将20℃的硝酸钾饱和溶液升温至60℃,溶解度增大,溶液变为不饱和溶液,无晶体析出,溶液的溶质质量分数不变,故D正确。
故选D

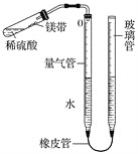
【题目】做完加热铜片的实验后,小明同学对其成分进行分析。取10g此样品,向其中分五次加入相同溶质质量分数的稀硫酸,使之充分反应,每次所用稀硫酸的质量及剩余固体的质量记录于下表:
第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
加入稀硫酸的质量/g | 20 | 20 | 20 | 20 | 20 |
充分反应后剩余固体的质量/g | 9.2 | 8.4 | 7.6 | 7 | 7 |
试回答下列问题:
(1)10g样品中氧化铜的质量为__________g。
(2)计算所加入稀硫酸中溶质的质量分数____________________。
【题目】化学兴趣A组的同学们利用废硫酸液制备K2SO4,设计的流程如下图所示:
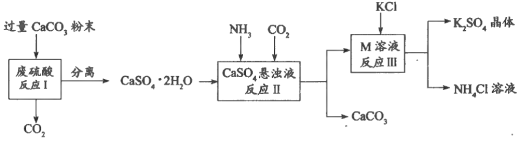
(1)写出反应Ⅰ的化学方程式:___________________________________________。
(2)反应Ⅱ生成了一种可用作氮肥的物质M,M的化学式为_________________。
(3)上述流程中可循环使用的物质有CO2和_____________________(填化学式)。
(4)反应Ⅲ中相关物质在25℃时的溶解度如下表。
物质 |
|
|
|
|
溶解度/g | 34.0 | 11.1 | 37.2 | 19.5 |
反应Ⅲ在常温下(25℃)能实现的原因是___________________________________。
(5)不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的目的是_____________;为了检验此晶体是否洗涤干净,常取最后一次洗涤液于试管中,先加入过量的_____________(选填字母),振荡、静置, 再向上层清液中滴加_____________(选填字母),观察现象即可判断该晶体是否洗涤干净。
A AgNO3溶液 B BaCl2溶液 C Ba(NO3)2溶液
D Ba(OH)2溶液 E NaOH溶液 F KOH溶液