题目内容
【题目】过氧化氢在生产生活中有着广泛的应用。化学实验小组对过氧化氢的某些性质进行了研究。
Ⅰ.不稳定性
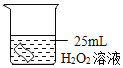
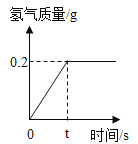
(1)如图所示进行实验(还测量收集的氧气体积),过氧化氢分解的化学方程式为_____。
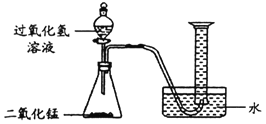
(2)能用排水法收集氧气的原因是_____。
(3)已知:常温常压下,氧气的密度为1.33gL﹣1.实验小组称量了10g溶质质量分数为 6%的过氧化氢溶液进行实验,如果将该过氧化氢溶液一次性全部放入锥形瓶中,则选择规格为_____mL(选填“50”、“200”或“250“”)的量筒收集氧气较为合适。
(4)实验小组同学还探究了温度对过氧化氢分解速率的影响,相关实验数据如表:
实验序号 | ① | ② | ③ |
H2O2溶液的浓度% | 30 | 30 | 30 |
H2O2溶液的体积/mL | 6 | 6 | 6 |
温度/℃ | 20 | 35 | 55 |
MnO2的用量/g | 0 | 0 | 0 |
反应时间/min | 40 | 40 | 40 |
收集O2的体积/mL | 0 | 1.9 | 7.8 |
由此得出的结论是_____。
Ⅱ.腐蚀性
(查阅资料)H2O2溶液有一定的腐蚀性。
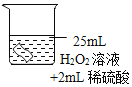
(进行实验)将铜片分别浸泡在以下3种溶液中进行实验,实验现象如下表:
编号 | ④ | ⑤ | ⑥ |
实验 |
|
|
|
一段时间后的现象 | 无明显变化 | 溶液变蓝,缓慢产生细小气泡 | 无明显变化 |
(解释与结论)
(5)实验④的作用是_____。
(6)实验⑤中铜片被腐蚀的反应为Cu+H2O2+H2SO4=CuSO4+□_____,请补全该反应的化学方程式。
(反思交流)
(7)小红同学提出,实验⑤中除发生(6)所给的反应外,还发生了另一个反应导致有细小的气泡产生,该反应的反应物是_____。
【答案】2H2O2![]() 2H2O+O2↑ 氧气不易溶于水,且氧气不与水反应 250 在其他条件相同的情况下,温度越高,H2O2分解速率越快 对照作用 2H2O 过氧化氢
2H2O+O2↑ 氧气不易溶于水,且氧气不与水反应 250 在其他条件相同的情况下,温度越高,H2O2分解速率越快 对照作用 2H2O 过氧化氢
【解析】
(1)过氧化氢在二氧化锰的催化作用分解生成水和氧气,化学方程式故填2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(2)能用排水法收集O2的原因是氧气不易溶于水且不与水反应,故填氧气不易溶于水,且氧气不与水反应;
(3)有题意可知反应物的质量是10g溶质质量分数为 6%的过氧化氢溶液,根据化学方程式进行计算,解:设称量了10g溶质质量分数为 6%的过氧化氢溶液进行实验,生成氧气的质量为x g,
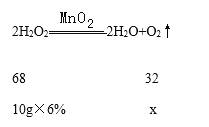
![]() =
=![]() 解得x≈0.282g,已知氧气的密度是1.33g/L,则生成氧气的体积为
解得x≈0.282g,已知氧气的密度是1.33g/L,则生成氧气的体积为![]() ≈0.212L=212mL,选择规格250mL的集气瓶收集氧气,故填250;
≈0.212L=212mL,选择规格250mL的集气瓶收集氧气,故填250;
(4)探究温度对过氧化氢分解速率的影响,其它条件相同的情况下,由表格数据得出的结论是温度越高,过氧化氢分解的越快,故填在其他条件相同的情况下,温度越高,H2O2分解速率越快;
(5)通过分析可知,实验④的作用是对照作用,故填对照作用;
(6)化学反应前后,元素种类不变,原子个数不变,反应物中有1个铜原子、4个氢原子、6个氧原子、1个硫原子,生成物中有1个铜原子、1个硫原子,4个氧原子,还差4个氢原子和2个氧原子,空白处是2H2O;
(7)有题意可知,实验④⑥都无气泡,说明铜、稀硫酸都不能加速过氧化氢分解,实验⑤中有气泡,说明过氧化氢可能在硫酸铜做催化剂的条件下生成水和氧气,反应物故填过氧化氢。

【题目】皮蛋又称松花蛋,因其风味独特,深受人们喜爱。某兴趣小组在市场上获得了少许腌制皮蛋的原料。拿到实验室进行实验。将该固体混合物放于烧杯中,缓慢加入足量的蒸馏水,充分溶解后过滤,得到白色沉淀A和无色澄清滤液B。
【提出问题】![]() 白色沉淀A是什么?
白色沉淀A是什么?
(2)无色滤液B中的溶质有哪些?
【查阅资料】腌制皮蛋的原料配方是少量NaCl、CaO和过量![]() 的固体混合物。
的固体混合物。
【理论推理】![]() 白色沉淀A是
白色沉淀A是![]() ,请写出生成该沉淀的化学方程式______。
,请写出生成该沉淀的化学方程式______。
![]() 滤液B中含有
滤液B中含有![]() 、NaOH、NaCl三种溶质。
、NaOH、NaCl三种溶质。
【实验验证】为证明滤液B中存在的三种溶质,同学们进行了如下实验。
步骤 | 实验操作 | 实验现象 | 实验结论 |
I | 取少量滤液B于试管中,加入过量的 | ______ | 滤液B中含有 |
II | 取少量步骤I中所得滤液于试管中,加入酚酞溶液 | ______ | |
III | 另取少量步骤I中所得滤液于试管中,先加入足量的稀硝酸,再加入 ______ 溶液 | 产生白色沉淀 |
【拓展提升】
![]() 向步骤I中加入过量
向步骤I中加入过量![]() 溶液的目的是______。
溶液的目的是______。
![]() 小妮同学认为若将步骤I中的
小妮同学认为若将步骤I中的![]() 溶液换为
溶液换为![]() 溶液,进行以上实验,最终也能证明滤液B中存在的三种溶质。你认为是否合理______
溶液,进行以上实验,最终也能证明滤液B中存在的三种溶质。你认为是否合理______![]() 填“合理”或“不合理”
填“合理”或“不合理”![]() 。
。
![]() 小轩同学认为向滤液B中先加入酚酞溶液,后加入过量的
小轩同学认为向滤液B中先加入酚酞溶液,后加入过量的![]() 溶液,也能得出滤液B的溶质中含有
溶液,也能得出滤液B的溶质中含有![]() 和NaOH的结论,你是否同意他的观点并说明理由______。
和NaOH的结论,你是否同意他的观点并说明理由______。