题目内容
【题目】元素周期表是学习和研究化学的重要工具。请根据下列信息回答有关问题。
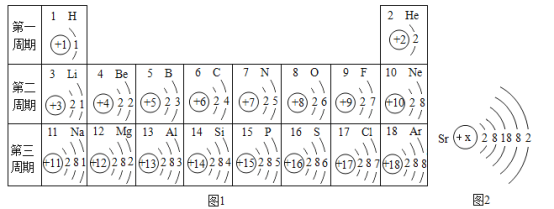
(1)16号元素的原子在化学反应中比较易_____(填“得”、“失”)电子,其离子符号是_____。
(2)不同种元素最本质的区别是_____。
(3)写出由8号、12号元素组成的化合物的化学式_____。
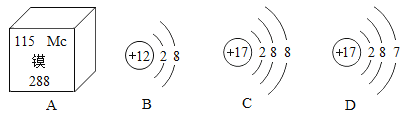
(4)如图2是元素锶(Sr)的原子结构示意图则x=_____。
【答案】得 S2﹣ 质子数不同 MgO 38
【解析】
(1)16号元素是硫元素,属于非金属元素,该元素的原子最外层电子数是6,在化学反应中比较容易得到2个电子形成带2个单位负电荷的硫离子,可以表示为S2﹣;
(2)不同种元素最本质的区别是质子数不同;
(3)12号元素是镁元素,镁元素的原子最外层电子数是2,在化学反应中比较容易失去2个电子形成带2个单位正电荷的钠离子,在化合价为+2,它与8号元素形成的化合物是氧化镁,氧化镁中镁元素化合价是+2,氧元素化合价是﹣2,根据化合物中元素化合价代数和为零可知,氧化镁的化学式为MgO;
(4)当质子数=核外电子数,为原子,由锶(Sr)的原子结构示意图,则x=2+8+18+8+2=38。

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案【题目】过氧化氢在生产生活中有着广泛的应用。化学实验小组对过氧化氢的某些性质进行了研究。
Ⅰ.不稳定性
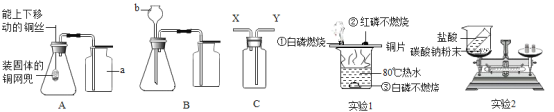
(1)如图所示进行实验(还测量收集的氧气体积),过氧化氢分解的化学方程式为_____。
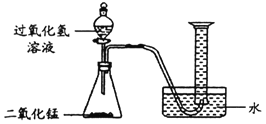
(2)能用排水法收集氧气的原因是_____。
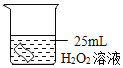
(3)已知:常温常压下,氧气的密度为1.33gL﹣1.实验小组称量了10g溶质质量分数为 6%的过氧化氢溶液进行实验,如果将该过氧化氢溶液一次性全部放入锥形瓶中,则选择规格为_____mL(选填“50”、“200”或“250“”)的量筒收集氧气较为合适。
(4)实验小组同学还探究了温度对过氧化氢分解速率的影响,相关实验数据如表:
实验序号 | ① | ② | ③ |
H2O2溶液的浓度% | 30 | 30 | 30 |
H2O2溶液的体积/mL | 6 | 6 | 6 |
温度/℃ | 20 | 35 | 55 |
MnO2的用量/g | 0 | 0 | 0 |
反应时间/min | 40 | 40 | 40 |
收集O2的体积/mL | 0 | 1.9 | 7.8 |
由此得出的结论是_____。
Ⅱ.腐蚀性
(查阅资料)H2O2溶液有一定的腐蚀性。
(进行实验)将铜片分别浸泡在以下3种溶液中进行实验,实验现象如下表:
编号 | ④ | ⑤ | ⑥ |
实验 |
|
|
|
一段时间后的现象 | 无明显变化 | 溶液变蓝,缓慢产生细小气泡 | 无明显变化 |
(解释与结论)
(5)实验④的作用是_____。
(6)实验⑤中铜片被腐蚀的反应为Cu+H2O2+H2SO4=CuSO4+□_____,请补全该反应的化学方程式。
(反思交流)
(7)小红同学提出,实验⑤中除发生(6)所给的反应外,还发生了另一个反应导致有细小的气泡产生,该反应的反应物是_____。