题目内容
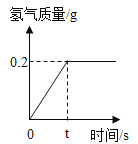
【题目】某同学称取一定质量的锌样品(含有少量不与稀硫酸反应的杂质),放入烧杯中,加入100g稀硫酸,恰好完全反应,生成气体的质量与反应时间的关系如图所示,试回答下列问题:
(1)化学反应的基本类型是______;
(2)样品中锌的质量是多少_____?稀硫酸的溶质质量分数是多少_____?(写出计算过程)
【答案】置换反应 6.5g 9.8%
【解析】
(1)锌与稀硫酸反应生成硫酸锌和氢气,反应的方程式故填Zn+H2SO4═ZnSO4+H2↑;反应物生成物均是一种单质和一种化合物,属于置换反应,故填置换反应;
(2)有题意可知恰好完全反应生成氢气质量为0.2g,根据化学方程式进行计算,解:设样品中锌的质量为X,所用稀硫酸中溶质的质量为Y,

![]() 解得X=6.5g,故填6.5g;
解得X=6.5g,故填6.5g;
![]() 解得Y=9.8g,根据题意稀硫酸中溶质的质量分数为
解得Y=9.8g,根据题意稀硫酸中溶质的质量分数为![]() ×100%=9.8%,写出答样品中金属锌的质量是 6.5g,所用稀硫酸中溶质的质量分数为9.8%,故填9.8%。
×100%=9.8%,写出答样品中金属锌的质量是 6.5g,所用稀硫酸中溶质的质量分数为9.8%,故填9.8%。

【题目】过氧化氢在生产生活中有着广泛的应用。化学实验小组对过氧化氢的某些性质进行了研究。
Ⅰ.不稳定性
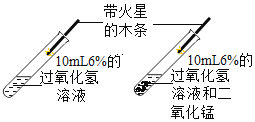
(1)如图所示进行实验(还测量收集的氧气体积),过氧化氢分解的化学方程式为_____。
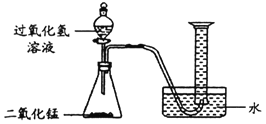
(2)能用排水法收集氧气的原因是_____。
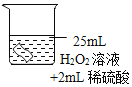
(3)已知:常温常压下,氧气的密度为1.33gL﹣1.实验小组称量了10g溶质质量分数为 6%的过氧化氢溶液进行实验,如果将该过氧化氢溶液一次性全部放入锥形瓶中,则选择规格为_____mL(选填“50”、“200”或“250“”)的量筒收集氧气较为合适。
(4)实验小组同学还探究了温度对过氧化氢分解速率的影响,相关实验数据如表:
实验序号 | ① | ② | ③ |
H2O2溶液的浓度% | 30 | 30 | 30 |
H2O2溶液的体积/mL | 6 | 6 | 6 |
温度/℃ | 20 | 35 | 55 |
MnO2的用量/g | 0 | 0 | 0 |
反应时间/min | 40 | 40 | 40 |
收集O2的体积/mL | 0 | 1.9 | 7.8 |
由此得出的结论是_____。
Ⅱ.腐蚀性
(查阅资料)H2O2溶液有一定的腐蚀性。
(进行实验)将铜片分别浸泡在以下3种溶液中进行实验,实验现象如下表:
编号 | ④ | ⑤ | ⑥ |
实验 |
|
|
|
一段时间后的现象 | 无明显变化 | 溶液变蓝,缓慢产生细小气泡 | 无明显变化 |
(解释与结论)
(5)实验④的作用是_____。
(6)实验⑤中铜片被腐蚀的反应为Cu+H2O2+H2SO4=CuSO4+□_____,请补全该反应的化学方程式。
(反思交流)
(7)小红同学提出,实验⑤中除发生(6)所给的反应外,还发生了另一个反应导致有细小的气泡产生,该反应的反应物是_____。
【题目】实验室常用双氧水与二氧化锰混合来制取氧气,写出相关反应的化学方程式:_____,小王同学对“双氧水分解快慢的影响因素”进行了探究.
(提出问题)双氧水分解快慢的影响因素有哪些?
(猜想与假设)猜想一:可能与二氧化锰的形状有关;猜想二:可能与温度有关.
(设计并实验)小王同学用8mL3%的双氧水和二氧化锰进行了如下实验(反应进行10s时,H2O2均有剩余);
实验编号 | 温度℃ | 二氧化锰的形状(均取0.4cm) | 收集到氧气的体积/mL(时间均为10s) |
① | 20 | 颗粒状 | a |
② | 30 | 粉末状 | b |
③ | 30 | 颗粒状 | c |
④ | 20 | 粉末状 | d |
(1)欲探究温度对”双氧水分解快慢“是否有影响,应该比较_____和_____(填“a”“b”“c”或“d”)的大小;若粉末状二氧化锰催化效果好,那么_____>_____(填“a”“b”“c”或“d”)
(2)其他条件相同,双氧水浓度可能会影响催化效果,请你设计实验方案进行验证:_____.
(3)小王同学还是用了压强传感器测不同质量二氧化锰对双氧水分解快慢的影响.他在8mL3%的双氧水中分别加入了0.03g,0.06g,0.08g,0.12g,0.24gMnO2.测得容器内压强的变化曲线如图所示(曲线的斜率表征催化反应的速率).请你观察图,并写出两条规律性结论:

①_____;
②_____.