题目内容
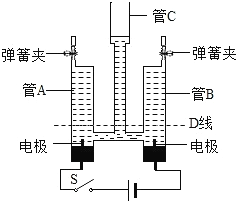
【题目】探究稀盐酸与氧化铝粉末发生反应的实验,烧杯中溶液总质量随时间的变化曲线如图所示。下列说法正确的是

A.b点对应溶液中的溶质是AlCl3
B.该实验是将氧化铝粉末逐渐加入稀盐酸中
C.a点和b点对应溶液蒸发结晶后得到的固体成分不相同
D.a点和b点对应溶液中铝元素的质量相等
【答案】D
【解析】
A、b点表示加入的盐酸过量,含有的溶质有氯化铝和氯化氢,故A错误。
B、溶液的总质量从零开始,所以该实验是将盐酸逐渐加入氧化铝中,故B错误;
C、盐酸具有挥发性,所以a点和b点对应溶液蒸发结晶后得到的固体成分相同,都是氯化铝,故C错误;
D、a点表示氧化铝和盐酸恰好完全反应,b点表示加入的盐酸过量,所以a点和b点对应溶液中铝元素质量相等,故D正确;
故选:D

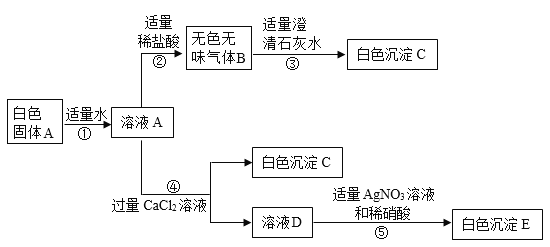
【题目】分类、类比、推理都是学习化学常用的方法。
(1)实验室制备某些气体的实验中,都能达到实验目的,但是其方案都有所不同,请从实验是否安全,操作是否简便,是否节约能源,是否环保等方面考虑,据此应将下列实验中的D与_____(填“A”或“B”或“C”)归为一类,依据是_____。
加热高锰酸钾制氧气 | 电解水制氢气 | 大理石和稀盐酸制二氧化碳 | 锌和硫酸制氢气 |
|
|
|
|
A | B | C | D |
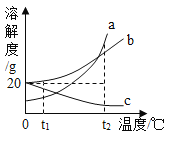
(2)今年春节期间,新冠肺炎席卷全国,为了防止疫情护散,人们使用了“84”高效消毒液,其主要成分为次氯酸钠(NaCIO),广泛用于机场、车站、宾馆,医院等公共场所的卫生消毒,制取次氯酸钠发生反应的化学方程式为![]() ,其中_____元素的化合价在化学反应前后既有升高义有降低。请你再写出一个符合在同一种物质中有一种元素的化合价在化学反应前后既有升高又有降低的反应的化学方程式_____(初中学过的)。
,其中_____元素的化合价在化学反应前后既有升高义有降低。请你再写出一个符合在同一种物质中有一种元素的化合价在化学反应前后既有升高又有降低的反应的化学方程式_____(初中学过的)。
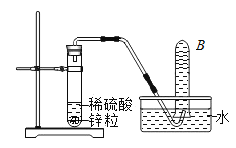
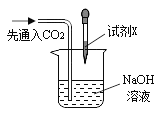
【题目】化学实验室里,同学们准备研究氢氧化钠能与二氧化碳反应的化学性质。
①在配制NaOH溶液时,看到盛有NaOH固体的试剂瓶上标注着“NaOH含量不少于96.0%”,便对该瓶试剂成分产生了质疑:
[提出问题]氢氧化钠中含有什么杂质?
[查阅资料]工业上制取NaOH的反应原理: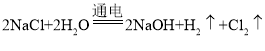 然后蒸发溶剂获得NaOH固体(在化工生产中,原料往往不能完全转化为产品)。
然后蒸发溶剂获得NaOH固体(在化工生产中,原料往往不能完全转化为产品)。
[提出猜想]
甲同学认为杂质只有氯化钠;
乙同学认为杂质还可能含有碳酸钠,原因为_______ (用化学方程式表示)。
[设计实验]取样溶于水,并分成两份。
步骤1:向一份溶液中滴加酚酞试液,溶液变_________色。
步骤2:向另一份溶液中滴加过量稀硝酸,有气泡产生。
步骤3:向步骤 2所得溶液中继续滴加_________溶液,发现有白色沉淀产生。
[实验结论]乙同学的猜想正确。
请
Ⅰ.上述实验中步骤_____(填序号)是没有必要进行的。
II.步骤2所得溶液中的溶质有________。
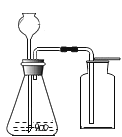
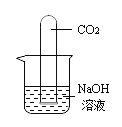
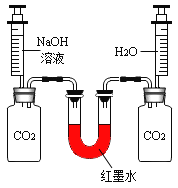
②同学们在配制好的氢氧化钠溶液中通入CO2气体,没有明显现象,于是设计了如下实验证明反应的发生:(不考虑氢氧化钠中的极少量杂质)
实验1 | 实验2 | 实验3 |
现象:烧杯中溶液几乎充满整个试管。 |
现象: 充分反应后,红墨水最终呈现左高右低现象。 |
现象: 滴加试剂X后,溶液中出现大量白色沉淀。 |
I .实验3中加入的试剂X是_______ (任写一种符合要求的试剂)。
II.实验1、2在设计思想上是一致的,都是通过验证反应物的消耗才能观察到明显现象,但有同学对实验1提出了质疑,他认为这个实验不足以证明CO2与NaOH发生了化学反应,其理由是_______。
Ⅲ.查阅资料:室温下,氢氧化钠易溶于酒精,而碳酸钠难溶于酒精。据此,同学们设计了实验4,请你补充完整。
实验4步骤 | 实验现象 | 实验结论 | 实验分析 |
将CO2气体不断地通入氢氧化钠酒精溶液中,观察现象。 | _______ | 氢氧化钠与二氧化碳确实发生了化学反应。 | 实验4与实验____(填实验序号)的设计思想是一致的,都是根据生成物的性质才能观察到明显现象。 |