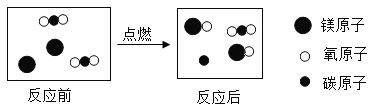
题目内容
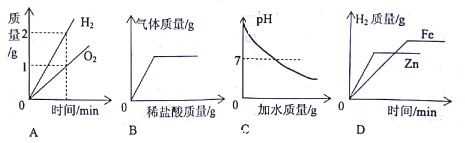
【题目】锌不但能与稀硫酸反应,还能与浓硫酸反应。现将19.5克锌加入含有49克H2SO4的浓硫酸溶液中,充分反应后,测得锌与硫酸恰好反应完全,得到SO2和H2的混合气体。已知锌与浓硫酸反应的化学方程式:Zn+2H2SO4(浓)═ZnSO4+SO2↑+2H2O。
(1)H2SO4由 (填元素名称)元素组成。
(2)ZnSO4中硫原子与氧原子的个数比为 。
(3)SO2的相对分子质量为 ,其中硫元素的质量分数为 。
(4)计算上述反应产生的气体中SO2的质量。(要求写出计算过程)
【答案】(1)氢、硫、氧;(2)1:4;(3)64;50%;(4)12.8g。
【解析】
解:(1)H2SO4由氢、硫和氧元素组成;
(2)ZnSO4中硫原子与氧原子的个数比为1:4;
(3)SO2的相对分子质量为32+2×16=64,其中硫元素的质量分数为![]() ×100%=50%;
×100%=50%;
(4)解:设生成硫酸锌消耗硫酸质量为x,产生SO2的质量为y。
由锌元素质量守恒可知,锌与浓硫酸(或稀硫酸)都会产生硫酸锌;
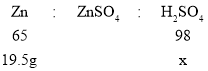
![]()
x=29.4g
浓硫酸中转化为SO2的硫酸质量为49g﹣29.4g=19.6g;
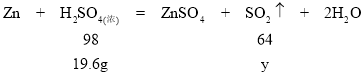
![]()
y=12.8g
答:产生的气体中SO2的质量是12.8g。

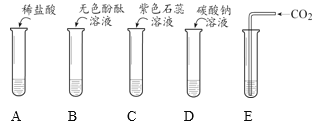
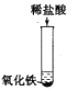
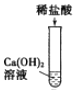
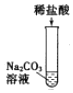
【题目】为探究酸的化学性质,某化学小组利用盐酸进行了如下实验操作:
实验 | A | B | C | D | E |
请回答:
(1)写出E中反应的化学方程式______。
(2)将反应后D、E试管中的废液倒入一个洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现。将烧杯中的混合物过滤,得到白色沉淀和无色滤液。同学们对滤液中溶质的成分进行如下探究:
(提出问题)滤液中溶质的成分是什么?
(作出猜想)
猜想一:NaCl
猜想二:NaCl和CaCl2
猜想三:NaCl、CaCl2和Na2CO3
猜想四:______。
(进行讨论)经过讨论,同学们一致认为猜想______是错误的。
(设计实验)请完成实验报告。
实验步骤 | 实验现象 | 实验结论 |
取少量滤液于试管中,滴加适量的碳酸钠溶液 | 无明显现象 | 猜想二不成立 |
取少量滤液于试管中,滴加氯化钡溶液 | ______ | 猜想四成立 |
(反思拓展)在分析化学反应后所得物质的成分时,除考虑生成物外还需考虑____。