题目内容
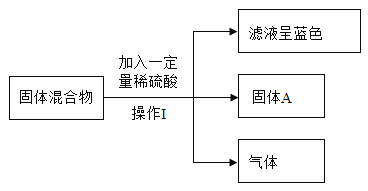
【题目】小东同学在化学实验室中发现一瓶白色粉末A,其残损的标签显示A是一种常见的钠盐。他想确定其成分,便取了少许固体A进行加热,发现它没有明显变化,又继续进行了如图所示的实验探究(假设所有能发生的反应都充分进行;图中部分产物省略)。
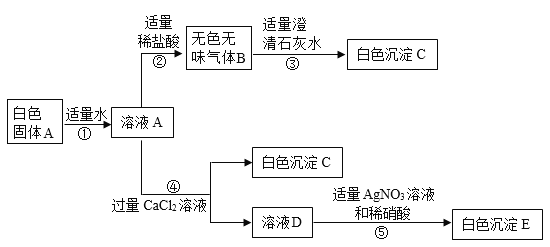
(1)写出步骤③中发生反应的化学方程式:________________。
(2)溶液D中,肯定含有的阳离子为_______________(填粒子符号)。
(3)由上述实验探究可知白色粉末A是________________。
(4)根据步骤⑤中的实验现象,小东同学分析并推断出溶液A中还混有NaCl,小亮不同意他的观点,理由是________________。
【答案】![]() Ca2+和Na+ 碳酸钠 第④步反应带入了氯离子,对实验造成了干扰
Ca2+和Na+ 碳酸钠 第④步反应带入了氯离子,对实验造成了干扰
【解析】
(1)钠盐与稀盐酸反应有气体B生成,故气体B是二氧化碳,二氧化碳和氢氧化钙反应生成碳酸钙白色沉淀和水,化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O;故答案为:CO2+Ca(OH)2=CaCO3↓+H2O;
(2)碳酸钠和氯化钙反应生成碳酸钙白色沉淀和氯化钠,因此溶液D中有氯化钠和氯化钙,阳离子是钠离子和钙离子;故答案为:Na+、Ca2+;
(3)A是一种常见的钠盐,便取了少许固体A先进行加热,发现它没有明显变化,说明A受热不易分解;碳酸钠溶液与盐酸反应生成氯化钠和水和二氧化碳,二氧化碳和氢氧化钙反应生成碳酸钙白色沉淀和水,因此A是碳酸钠,B是二氧化碳,C是碳酸钙;故答案为:Na2CO3;
(4)根据步骤⑤中的实验现象,小莉同学分析并推断出溶液A中还混有NaCl,我不同意他的观点,因为第④步就生成氯化钠,要想分析推断出溶液A中是否还混有NaCl,需要定量计算;故答案为:不同意;因为第④步反应带入了氯离子,对实验造成了干扰

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案【题目】某小组进行了如下实验,请回答下列问题。
序号 | 甲 | 乙 | 丙 |
实验 |
|
|
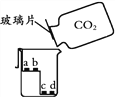
a、c为干燥的紫色石蕊试纸 b、d为湿润的紫色石蕊试纸 |
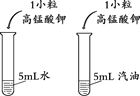
(1)甲实验的目的是________。
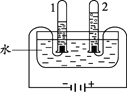
(2)乙实验,若电解18g 水,则试管2内得到的气体质量为_____g 。
(3)丙实验,说明二氧化碳密度大于空气且能与水反应的现象是________________。