题目内容
我们知道二氧化碳与水反应生成碳酸,那么二氧化硫与水是否也能反应生成一种酸呢?某实验小组对此进行探究,设计的探究过程如下。请你回答其中的有关问题:
(1)做出假设: ;
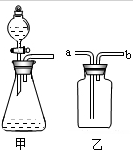
(2)设计方案:先验证水能否使蓝色石蕊试纸变色,再验证二氧化硫气体能否使干燥的蓝色石蕊试纸变色,最后验证二氧化硫气体能否使湿润的蓝色石蕊试纸变红,实验装置和药品如图:
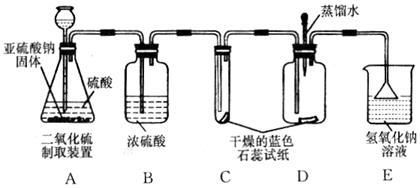
(3)查阅资料:你认为该实验小组需要掌握的资料内容中应包括(填序号)
①二氧化硫易溶于水 ②酸能使湿润的蓝色石蕊试纸变红 ③SO2不与浓硫酸反应 ④二氧化硫有毒,能与碱溶液反应生成盐和水
(4)实验:
①实验过程中装置C内石蕊试纸的颜色始终没有变化,这说明 。
②装置D中胶头滴管中的蒸馏水在二氧化硫气体生成之前滴到蓝色石蕊试纸上,未见试纸颜色发生变化,当有二氧化硫气体通过时发现湿润的蓝色石蕊试纸变红。此现象说明 ,此过程中反应的化学方程式为 。
③装置E的作用是 。
(5)结论:原假设 (填“成立”或“不成立”)
(1)做出假设: ;
(2)设计方案:先验证水能否使蓝色石蕊试纸变色,再验证二氧化硫气体能否使干燥的蓝色石蕊试纸变色,最后验证二氧化硫气体能否使湿润的蓝色石蕊试纸变红,实验装置和药品如图:

(3)查阅资料:你认为该实验小组需要掌握的资料内容中应包括(填序号)
①二氧化硫易溶于水 ②酸能使湿润的蓝色石蕊试纸变红 ③SO2不与浓硫酸反应 ④二氧化硫有毒,能与碱溶液反应生成盐和水
(4)实验:
①实验过程中装置C内石蕊试纸的颜色始终没有变化,这说明 。
②装置D中胶头滴管中的蒸馏水在二氧化硫气体生成之前滴到蓝色石蕊试纸上,未见试纸颜色发生变化,当有二氧化硫气体通过时发现湿润的蓝色石蕊试纸变红。此现象说明 ,此过程中反应的化学方程式为 。
③装置E的作用是 。
(5)结论:原假设 (填“成立”或“不成立”)
二氧化硫和水反应生成一种酸 ①②③④ 二氧化硫单独不能使蓝色石蕊变红 水单独不能使蓝色石蕊变红,而水和二氧化硫反应生成一种酸使蓝色石蕊变红 SO2 + H2O ="=" H2SO3 吸收二氧化硫,防止污染空气 成立(答案要与第一空对应)
试题分析:(1)根据二氧化硫与二氧化碳具有相似的组成,故可猜想二氧化硫也能象二氧化碳一样,能与水反应生成酸(当然也可以做出相反的假设:二氧化硫不能与水发生反应生成酸)。
(3)根据题意,结合图示可知,由于③SO2不与浓硫酸反应,故气体可用浓硫酸干燥(B);由于①二氧化硫易溶于水,故在D装置中,二氧化硫气体会溶解在先前滴加的水中,并反应生成酸;由于②酸能使湿润的蓝色石蕊试纸变红,故通过D中的石蕊变红能证明反应中生成了酸;由于④二氧化硫有毒,能与碱溶液反应生成盐和水,所以要进行尾气处理(E),由此可知,①②③④的知识都需掌握。
(4)①装置C内蓝色石蕊试纸虽然与二氧化硫气体(干燥的)接触,但却不变色,可以说明二氧化硫气体不能使干燥的蓝色试纸变色;
②未通入二氧化硫气体前,向蓝色试纸上滴水,试纸不变色,说明水不能使蓝色石蕊试纸变色;当湿润的蓝色石蕊试纸遇到二氧化硫气体时,试纸由蓝色变成了红色,说明试纸遇到了酸性物质;而根据C装置中的现象可知,二氧化硫并不能使试纸变红,因此,可推断二氧化硫与水反应生成了酸,而使试纸变红;结合二氧化碳能与水反应生成碳酸,可类比猜测二氧化硫与水反应生成亚硫酸;故反应的化学方程式为SO2+H2O═H2SO3;
③由于二氧化硫有毒,直接排放到空气中,会对空气造成污染,结合二氧化硫能与氢氧化钠溶液反应的性质,可把多余的有毒气体二氧化硫用氢氧化钠溶液吸收,以防止气体对空气的污染。
(5)根据以上实验探究可知,二氧化硫能与水反应生成亚硫酸,与所做的假设一致,因此,假设成立。
点评:对于验证型实验探究,要熟记物质的性质或变化规律,根据给出的实验设计方案,进行实验、分析和探究,并通过观察、记录和分析的实验现象,来验证该物质的性质或变化规律等。

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目