题目内容
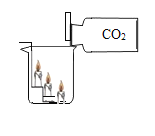
【题目】许多家庭做饭时使用的一种 “煤气” 罐,罐中所装的是液化石油气,液化石油气的主要成分是丙烷(C3H8)、丁烷(C4H10)、丙烯(C3H6)和丁烯(C4H8)等,
试问:
①液化石油气属于_____(填“混合物”或“化合物”)。
②通常情况下,液化石油气各成分充分燃烧生成二氧化碳和水。写出丁烯充分燃烧的化学方程式:_____
③煤气泄漏时能闻到一股难闻的气味,用分子观点解_____
④煤气泄漏在空气中达到一定比例遇明火还会爆炸,所以做完饭一定要及时关紧阀门,关闭阀门的灭火原理为_____.
【答案】混合物 C4H8+6O2 4CO2+4H2O 分子在不断的运动 清除可燃物
4CO2+4H2O 分子在不断的运动 清除可燃物
【解析】
①液化石油气的主要成分是丙烷、丁烷、少量的丙烯和丁烯,因此液化石油气属于混合物;
②丁烯燃烧生成二氧化碳和水,反应的化学方程式:C4H8+6O2 4CO2+4H2O;
4CO2+4H2O;
③煤气泄漏时能闻到一股难闻的气味,用分子观点解释就是分子在不断的运动;
④煤气是可燃物,做完饭一定要及时关紧阀门,关闭阀门的灭火原理为清除可燃物。

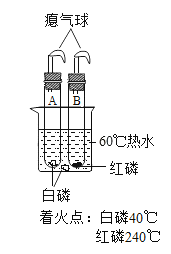
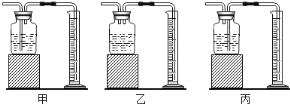
【题目】用如图所示装置,在常温下分别进行研究燃烧条件和研究氧气性质的实验。已知:白磷的着火点为40 ℃。
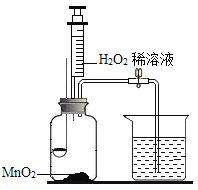
内容 | (实验1)研究燃烧的条件 | (实验2)研究氧气性质 |
Ⅰ | 烧杯中盛有80℃的热水,分别在燃烧匙和烧杯中导管口放置一小块白磷,塞紧瓶塞。 | 烧杯中盛有澄清石灰水,燃烧匙中放入木炭,点燃木炭后,迅速将燃烧匙伸入瓶中,塞紧瓶塞。 |
Ⅱ | 推入适量H2O2溶液 | 推入适量H2O2溶液 |
(1)实验1中,推入H2O2溶液前,燃烧匙和水中的白磷均不燃烧,原因分别是________、__________。推入H2O2溶液后,观察到烧杯中的现象是____________。
(2)实验2中,推入H2O2溶液后,观察到木炭燃烧得更剧烈,其反应化学方程式_______,由此得出氧气的性质是________;打开弹簧夹,还能观察到的现象是_______,其反应化学方程式________。木炭熄灭后冷却一段时间,烧杯中部分溶液流入集气瓶。
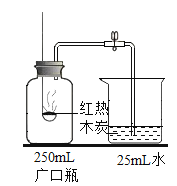
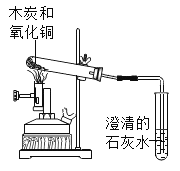
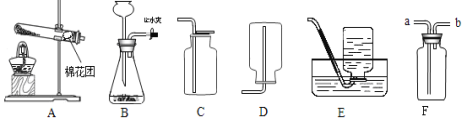
【题目】化学实验是培养化学素养的重要途径。根据以下实验回答问题:
A证明二氧化碳密度比空气大 | B 探究可燃物燃烧的两个条件 | C 测定空气中氧气的体积分数 | D 验证木炭能和氧化铜反应 |
|
|
|
|
(1)A 中观察到的现象是_____。
(2)B 中水的作用是隔绝空气和_____。
(3)C 中红热木炭和氧气反应的化学方程式为_____。
(4)D 中实验结束时,应先_____(选填“取出导管”或“停止加热”)。
(5)对不能达到目的的实验,你的改进措施是_____。
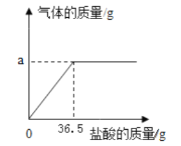
【题目】为确定15.8g高锰酸钾完全分解能产生氧气的质量,小柯与小妍两位同学采用方法如下。根据他们测试方法,回答及计算:
小柯:实验测定法 | 小妍:计算法 |
在老师指导下,将15.8g高锰酸钾充分加热,得到氧气1120mL | 解:高锰酸钾中氧元素的质量分数: |
(1)大家经过讨论,认为小妍采用该方法计算氧气质量错误。理由是_______。
A 高锰酸钾中含氧元素
B 锰酸钾和二氧化锰中含氧元素
C 氧气中含氧元素
(2)已知:在小柯的实验条件下,氧气的密度为1.429g/L,小柯得到的氧气的质量_____(结果保留一位小数)。
(3)15.8g高锰酸钾完全分解产生的氧气的质量为__________(要求有解题过程)。
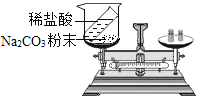
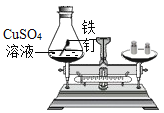
【题目】化学实验技能是学习化学和进行探究活动的基础和保证。以下是老师引导学生探究“质量守恒定律”的教学片段,请你参与探究:
(提出问题)化学反应前后各物质的质量总和是否相等?
(猜想与假设)猜想1:不相等;猜想2:_____。
(实验探究)甲、乙两组同学用托盘天平分别称量反应前后物质的质量。
甲组 | 乙组 | |
实验方案(反应后略) |
|
|
实验现象 | 有气泡产生,天平指针向右偏转 | 铁钉表面有红色物质析出,溶液由蓝色变为浅绿色,天平指针没有偏转 |
结论 | 猜想1正确 | 猜想2正确,反应的化学方程式:_____ |
(反思与评价)究竟哪种猜想正确?通过讨论,同学们发现甲组中有气体逸出,导致指针向右偏转。得到启示:在探究化学反应前后各物质的质量总和是否相等时,凡有气体生成或参加的反应一定要在_____中进行。
(优化装置)同学们对甲组左盘中的反应装置进行了如下三种改进,查阅资料后发现最佳装置是B,则猜想B中氢氧化钠具有的化学性质是_____。
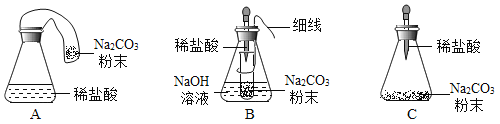
(得出结论)同学们利用改进后的最佳装置进行再次探究,均得出猜想2正确。