题目内容
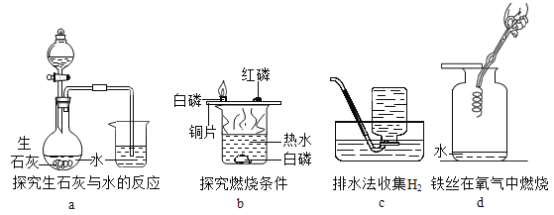
【题目】用如图所示装置,在常温下分别进行研究燃烧条件和研究氧气性质的实验。已知:白磷的着火点为40 ℃。
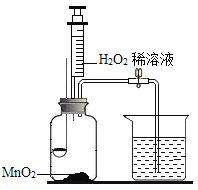
内容 | (实验1)研究燃烧的条件 | (实验2)研究氧气性质 |
Ⅰ | 烧杯中盛有80℃的热水,分别在燃烧匙和烧杯中导管口放置一小块白磷,塞紧瓶塞。 | 烧杯中盛有澄清石灰水,燃烧匙中放入木炭,点燃木炭后,迅速将燃烧匙伸入瓶中,塞紧瓶塞。 |
Ⅱ | 推入适量H2O2溶液 | 推入适量H2O2溶液 |
(1)实验1中,推入H2O2溶液前,燃烧匙和水中的白磷均不燃烧,原因分别是________、__________。推入H2O2溶液后,观察到烧杯中的现象是____________。
(2)实验2中,推入H2O2溶液后,观察到木炭燃烧得更剧烈,其反应化学方程式_______,由此得出氧气的性质是________;打开弹簧夹,还能观察到的现象是_______,其反应化学方程式________。木炭熄灭后冷却一段时间,烧杯中部分溶液流入集气瓶。
【答案】温度未达到白磷的着火点 白磷未与氧气接触 导管口有气泡冒出,白磷燃烧 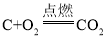 支持燃烧 澄清石灰水变浑浊
支持燃烧 澄清石灰水变浑浊 ![]()
【解析】
(1)燃烧需要同时满足三个条件:①可燃物、②氧气或空气、③温度要达到着火点,推入过氧化氢溶液前,燃烧匙和水中的白磷均不燃烧,原因分别是温度未达到白磷的着火点、白磷未与氧气接触。推入过氧化氢溶液后,过氧化氢在二氧化锰的催化作用下生成氧气,烧杯中白磷能与氧气据接触,温度达到了着火点,故观察到烧杯中的现象是导管口有气泡冒出,白磷燃烧。
(2)实验2中,推入过氧化氢溶液后,有氧气生成,观察到木炭燃烧得更剧烈,木炭在氧气中燃烧生成二氧化碳,反应的化学方程式为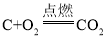 ,说明氧气能支持燃烧;打开弹簧夹,二氧化碳从导管排出,与氢氧化钙反应生成碳酸钙沉淀和二氧化碳,故还能观察到的现象是澄清石灰水变浑浊,其反应化学方程式为
,说明氧气能支持燃烧;打开弹簧夹,二氧化碳从导管排出,与氢氧化钙反应生成碳酸钙沉淀和二氧化碳,故还能观察到的现象是澄清石灰水变浑浊,其反应化学方程式为![]() 。
。

 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案【题目】金属及其制品是现代生活中常见的材料,请回答下列问题:
(1)铁和铝都可以制作炊具,主要利用了它们的_____ (填 “导电”或“导热”)性。
(2)依据金属活动性顺序,可知人类对铝的利用要比铜和铁_____(填“早”或“晚”)得多。
(3)有X、Y、Z三种不同的金属,分别与硫酸铜溶液、稀硫酸反应,实验记录如下表(表中“√”表示能反应,“一” 表示不能反应)则X、Y、 Z三种金属元素活动性由强到弱的顺序是_____。
X | Y | Z | |
硫酸铜溶液 | √ | √ | |
稀硫酸 | √ |
(4)向硫酸亚铁和硫酸铜的混合溶液中加入一些锌粉, 充分反应后过滤。若向滤渣中滴加稀盐酸有气泡产生,则滤渣中一定含有的金属是_____,滤液中一定含有的溶质是_____。
(5)现有20g 赤铁矿石(其中杂质不参与反应)样品,用一氧化碳充分还原后,得到固体剩余物共15.5g,请计算该赤铁矿石中氧化铁的百分含量为_____。