题目内容
【题目】在化学兴趣小组活动中,老师为大家变了一个“水生火”的魔术:在两片蓬松的脱脂棉中间包夹一些淡黄色固体粉末,做成“夹心饼干”。用胶头滴管向“夹心饼干”上滴水。数滴后“夹心饼干”燃烧起来。经老师介绍,该淡黄色固体为过氧化钠(Na2O2),能与水反应生成一种常见可溶性固体化合物X和一种常见气体Y。
(提出问题)化合物X和气体Y分别是什么?
(作出猜想)同学们认为X应为NaOH,但对Y的成分产生了分歧,猜想:①O2;②H2;③CO2;
经讨论,猜想_____(填序号)肯定不合理,理由是_____。
老师指导:同一化学反应中,若有元素化合价降低,必有元素化合价升高。Na2O2中O元素显—1价。
结合以上规律,你认为气体Y的化学式为_____。
(实验验证)
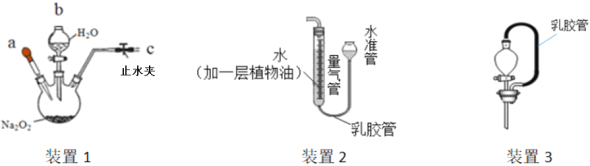
实验步骤 | 实验现象 | 实验结论 |
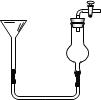
① _____,向分液漏斗中加水,打开 分液漏斗活塞 | 分液漏斗中有一段稳定的水柱 | 装置1气密性良好 |
②取少量Na2O2于三颈烧瓶中,打开止水夹,加入适量水 | 固体溶解,形成无色溶液,有气泡产生 | |
③从a处滴管滴加CuSO4溶液 | _____ | X为NaOH |
写出Na2O2与H2O反应的化学方程式_____;
(发现问题)Na2O2固体敞口放置一段时间后,有细心的同学发现其中含有少量白色粉末。
(查阅资料)Na2O2在空气中可以和CO2反应而变质,生成Na2CO3和O2。
(定量探究)测定该Na2O2样品中Na2CO3的质量分数。
①取5.0g该样品于装置1中,加水配成溶液,冷却至室温;
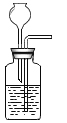
②将装置2与装置1连接;将b处分液漏斗替换为装置3(内盛稀硫酸);
③上下调节装置2的水准管至左右两管液面相平,记录左管中液面读数为20.0mL;
④用装置3向溶液中滴加稀硫酸至_____(填实验现象);
⑤再次上下调节装置2的水准管至左右两管液面相平;
⑥记录左管中液面读数为80.0mL;
已知CO2在该实验环境下的密度约为1.8×10-3g/mL,根据实验数据计算:
(1)生成CO2的质量为_____g(计算结果精确到0.01);
(2)该Na2O2样品中Na2CO3的质量分数(写出计算过程)_____;
(实验分析)用装置3替换分液漏斗的优点是_____;
(魔术揭秘)“水生火”的原理:
①脱脂棉具有可燃性;②脱脂棉与O2接触;③从能量变化的角度Na2O2与H2O的反应是_____反应。
【答案】③ 反应物中不含碳元素 O2 关闭止水夹 产生蓝色沉淀 ![]() 不再产生气泡 0.11 5.3% 使装置内的压强与分液漏斗内的压强相等 放热
不再产生气泡 0.11 5.3% 使装置内的压强与分液漏斗内的压强相等 放热
【解析】
[作出猜想]:根据质量守恒定律和元素的化合价分析;
[实验验证]:根据装置气密性的检查方法和物质反应的现象分析;
[定量探究]:根据化学反应现象和化学方程式的计算分析;
[实验分析]:根据实验装置的优点分析;
[魔术揭秘]:根据可燃物燃烧的条件分析。
[作出猜想]根据质量守恒定律,化学变化前后元素的种类不变,而反应物过氧化钠(Na2O2)粉末和水中无碳元素,故反应物中不可能含有CO2;同一化学反应中,若有元素化合价降低,必有元素化合价升高。Na2O2中O元素显-1价,H2O中O元素显-2价,H元素显+1价,生成物NaOH中O元素显-2价,H元素显+1价,故O元素化合价降低,假设生产H2,H元素化合价也降低,结合以上规律,故气体Y的化学式为O2。故填:③;反应物无碳元素;O2。
[实验验证]:装置气密性的检查方法:关闭止水夹,向分液漏斗中加水,打开分液漏斗活塞,分液漏斗中有一段稳定的水柱,说明装置1气密性良好;CuSO4溶液NaOH溶液反应,生成蓝色的Cu(OH)2沉淀,Na2O2与H2O反应生成NaOH和O2,化学方程式为![]() 。故填:关闭止水夹;产生蓝色沉淀,
。故填:关闭止水夹;产生蓝色沉淀,![]() 。
。
[定量探究]:测定该Na2O2样品中Na2CO3的质量分数滴加稀硫酸, Na2CO3与稀硫酸反应有气泡产生,当不再产生气泡时,说明Na2CO3反应已消耗完。故填:不再产生气泡;
生成二氧化碳的质量为:1.8×10-3g/mL ×(80 mL-20 mL)=0.11g,故填:0.11g;
解:设碳酸钠质量为x。
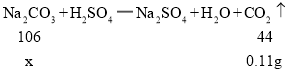
x=0.265g
部分变质的氢氧化钠固体中碳酸钠的质量分数为:![]()
答:碳酸钠的质量分数为5.3%.
[实验分析]:装置3用乳胶管连接分液漏斗口与装置内,优点是使装置内的压强与分液漏斗内的压强相等,使分液漏斗内的液体容易滴下;故填:使装置内的压强与分液漏斗内的压强相等;
[魔术揭秘]:脱脂棉能够燃烧,温度需达到脱脂棉的着火点,该反应为放热反应,从而使温度达到脱脂棉的着火点。故填:放热。

 步步高达标卷系列答案
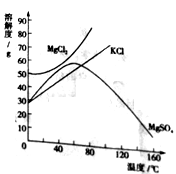
步步高达标卷系列答案【题目】溶解是生活中常见的现象,不同物质在水中的溶解能力不同。下表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g水)。
温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 |
KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
(1)上表中的两种物质在40℃时,_______(填化学式)的溶解度较大。
(2)请写出一种将KNO3的不饱和溶液转化为饱和溶液的方法____________________。
(3)20℃时,将20gNaCl放入50g水中,所得溶液的质量是______g。
(4)从NaCl溶液中得到NaCl晶体的方法是________。
(5)请用表格中的数据计算20℃时,NaCl饱和溶液的质量分数_________。