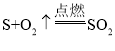
题目内容
【题目】课堂上老师按图Ⅰ装置进行分子运动实验时同学们闻到了一股难闻的刺激性气味课后在老师的指导下同学们对原实验装置进行了改进装置如图Ⅱ所示,
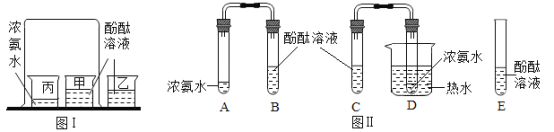
(1)图I大烧杯中的实验现象是_____。
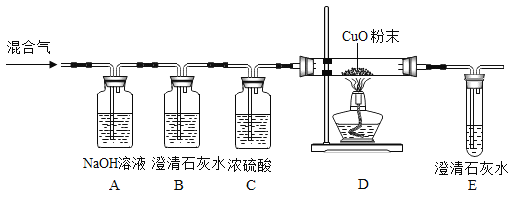
(2)同学们按图Ⅱ装置进行了如下实验操作。
(步骤1)向B、C、E三支试管中分别加入5mL的蒸馏水各滴入1~2滴无色酚酞溶液,振荡,观察溶液颜色。
(步骤2)在A、D试管中分别加入2mL浓氨水,立即用带橡皮塞的导管按实验图Ⅱ连接好并将D试管放置在盛有热水的烧杯中。
回答问题:
①实验中,E所起的作用是_____;图Ⅱ,实验中观察到的现象是B 试管中_____,C试管中_____。
②除了证明分子运动,由此实验还可以得到的结论是_____;_____。
③对比改进前的实验,改进后实验的优点是_____。
【答案】甲中液体变红 作对比 酚酞溶液慢慢变红色 酚酞溶液很快变红色 氨水能使酚酞溶液变红 温度越高,分子运动越快 防止氨水扩散到空气中,同时可以证明分子的运动快慢与温度的关系
【解析】
(1)浓氨水具有挥发性,挥发出氨气遇到的酚酞试液变红。故甲烧杯中溶液由无色逐渐变红;
(2)①E试管放有酚酞溶液的目的是与B、C中的酚酞溶液做对照或者对比;
②图Ⅱ实验可以看出C中酚酞溶液比B中先变红,因为D放在热水中,氨分子运动的快。由此可以得到的实验结论是:①浓氨水显碱性,能使酚酞溶液变红 ②分子在不断运动,且温度越高,分子运动越剧烈;
③对比改进前的实验,改进后实验的优点是能够防止氨气扩散到空气中,污染大气;能够得出在不同温度下分子运动的剧烈程度的差异。
故答案为:(1)甲中液体变红;
(2)①作对比;B试管中的酚酞溶液慢慢变红色,C试管中的酚酞溶液很快变红色;
②氨水能使酚酞溶液变红;温度越高,分子运动越快;
③防止氨水扩散到空气中,同时可以证明分子的运动快慢与温度的关系。

【题目】甲同学为了区别氢氧化钠和氢氧化钙溶液,设计了如图所示的四组实验方案。

(1)其中能达到实验目的的是_____。
(2)在C组实验中发生的化学方程式为_____。
(3)实验结束后,甲同学将A、C组四支试管中的溶液倒入同一容器中,看到溶液变浑浊,该现象说明有_____生成(填化学式),滴入酚酞后溶液呈红色。
(4)滴入酚酞后溶液呈红色,说明溶液呈碱性。使溶液呈碱性的物质是什么呢?甲同学进一步推测:溶液中呈碱性的物质可能是碳酸钠、氢氧化钙和NaOH三种物质中的一种,或是三种物质两两混合组成的混合物。
(5)为了验证推测,甲同学查阅资料,获悉氯化钡溶液呈中性,并设计如下实验加以验证。请根据要求完成下列空白:
实验内容 | 预测现象 | 结论 |
取少量容器中的上层溶液于试管中,加入过量的氯化钡溶液,静置 | ①若有白色沉淀,溶液呈无色 | 物质是碳酸钠 |
②若无沉淀生成,溶液呈红色 | 物质是氢氧化钙 | |
③若有白色沉淀,溶液呈红色 | ___________________ |
(6)乙同学认为甲同学第②步验证的结论不严密,原因是_____。
【题目】为测定含少量氯化钠杂质的纯碱样品中碳酸钠的质量分数。某化学兴趣小组进行如下实验,取5.7g的样品放置于烧杯中,加入30g水全部溶解,向烧杯中滴加一定质量的10%的稀盐酸,恰好完全反应。反应过程用精密仪器测得烧杯和药品的质量与反应时间的数据记录如下:
反应时间/s | 0 | 5 | 10 | 15 | 20 | 25 |
烧杯与药品的质量/g | 207.8 | 207.25 | 206.7 | 206.15 | 205.6 | 205.6 |
通过计算回答:
(1)产生的二氧化碳的质量是多少克_______;
(2)样品中碳酸钠的质量分数_______(结果保留到0.1%,下同);
(3)所得到的溶液中溶质的质量分数_______。