题目内容
【题目】为测定含少量氯化钠杂质的纯碱样品中碳酸钠的质量分数。某化学兴趣小组进行如下实验,取5.7g的样品放置于烧杯中,加入30g水全部溶解,向烧杯中滴加一定质量的10%的稀盐酸,恰好完全反应。反应过程用精密仪器测得烧杯和药品的质量与反应时间的数据记录如下:
反应时间/s | 0 | 5 | 10 | 15 | 20 | 25 |
烧杯与药品的质量/g | 207.8 | 207.25 | 206.7 | 206.15 | 205.6 | 205.6 |
通过计算回答:
(1)产生的二氧化碳的质量是多少克_______;
(2)样品中碳酸钠的质量分数_______(结果保留到0.1%,下同);
(3)所得到的溶液中溶质的质量分数_______。
【答案】2.2g 93.0% 8.9%
【解析】
(1)根据质量守恒定律可得,减少的质量即为生成的二氧化碳的质量,即:207.8g-205.6g=2.2g。
(2)设样品中碳酸钠的质量为x,盐酸中溶质的质量为y,生成氯化钠的质量为z
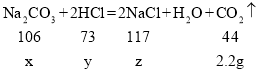
![]()
解得x=5.3g,y=3.65g,z=5.85g。
则样品中碳酸钠的质量分数为:![]() ×100%≈93.0%
×100%≈93.0%
(3)所得溶液中溶质为生成的氯化钠和原混合物中混有的氯化钠的质量,即:5.85g+(5.7-5.3)g=6.25g。
盐酸的质量:3.65g÷10%=36.5g
所得溶液的质量:5.7g+30g+36.5g-2.2g=70g
所得到的溶液中溶质的质量分数:![]() ×100%≈8.9%
×100%≈8.9%

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案
相关题目