题目内容
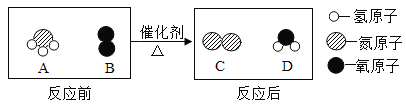
【题目】黄铜渣中约含 Zn7%,ZnO 31%,Cu 50%,CuO 5%,其余为杂质。处理黄铜渣可得到硫酸锌,其主要流程如下(杂质不溶于水、不参与反应)
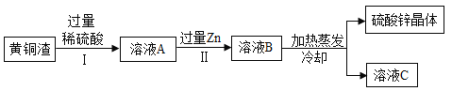
下列说法不正确的是( )
A. Ⅰ、Ⅱ中的操作均包含过滤
B. Ⅰ、Ⅱ中的现象均包含有无色气泡生成
C. Ⅰ中发生 2个化学反应
D. 溶液 B中只含硫酸锌和水
【答案】C
【解析】
A、由图可知,操作Ⅰ过滤后得铜,操作Ⅱ过滤是除去锌,说法正确;
B、Ⅰ为稀硫酸与锌反应生成气体;Ⅱ过量的锌与Ⅰ中的剩余稀硫酸反应,故二者现象均包含有无色气泡生成,说法正确;
C、Ⅰ中稀硫酸与锌、氧化铜、氧化锌发生反应,为3个化学反应,故说法错误;
D、溶液A中溶质为硫酸锌、硫酸铜;溶液A与过量锌反应后,则溶液B中只含硫酸锌和水,故说法正确。故选C。

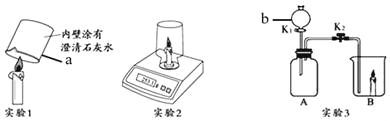
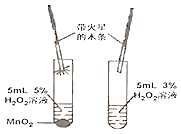
【题目】为了测定实验室某生锈铁片中铁元素的质量分数,两位同学分别设计了如下甲、乙两个实验方案。方案甲:称得生锈铁片的质量为 m1g,按图 I 所示装置进行实验。完全反应后,测得室温下产生氢气的体积为 V1L,查得其密度为p1g/L。方案乙:称得生锈铁片的质量为 m2g,先按图Ⅱ所示装置进行实验。当生锈铁片完全变成光亮的银白色时,停止加热,继续通入CO至室温。取出铁片,按图 I 所示装置继续进行实验。完全反应后,测得室温下产生氢气的体积为 V2L,查得其密度为 p2g/L。
已知:Fe2O3+6HCl=2FeCl3+3H2O(FeCl3可溶于水)
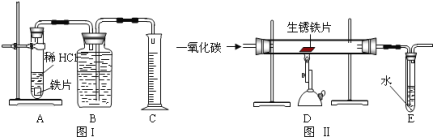
(1)铁锈的成分是__________.
(2)(评价交流)上述两个方案中,可行的是____(填“甲”或“乙”);分析不可行方案,其缺陷是____________________。
(3)(设计实验)方案乙中,同学们设计了如下实验报告,请帮助完成表中空格。
实验编号 | 实验步骤 | 实验现象 | 结论或化学方程式 |
①装置Ⅱ | 通入CO,加热.完全反应后,停止加热,继续通CO至室温 | 生锈铁片变成光亮的银白色 | CO具有______性; 化学方程式:_______ |
②装置Ⅰ | 将光亮铁片放入稀盐酸中,完全反应 | ______ |
(4)图Ⅱ所示装置有缺陷,应如何改进__________。
(5)(结论)生锈铁片中铁元素的质量分数是_________(用字母表示)。
(6)(发散)实验室经常用一氧化碳来炼铁,实验室炼的铁和工业炼的铁本质区别是_______________