题目内容
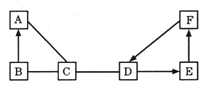
【题目】X、Y 两种固体溶解度曲线如图所示,下列说法正确的是
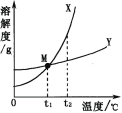
A. X 的溶解度比 Y 的溶解度大
B. t2℃时,X 溶液的浓度比 Y 溶液的浓度大
C. 将 X、Y 的饱和溶液分别从 t2℃降温到 t1℃,两种溶液的浓度相同
D. 将 t1℃时 X 的饱和溶液升温至 t2℃,X 溶液的浓度增大
【答案】C
【解析】
A、在比较物质的溶解度时,需要指明温度,故A错误;
B、t2℃时,X、Y溶液的状态不能确定,所以浓度的大小无法确定,故B错误;
C、X、Y溶解度随温度降低而降低,将 X、Y 的饱和溶液分别从 t2℃降温到 t1℃,两种溶液都有溶液析出,仍为饱和溶液,一定温度下饱和溶液的溶质分数=![]() ,t1℃时,两种物质的溶解度相等,两种溶液的浓度相同,故C正确;
,t1℃时,两种物质的溶解度相等,两种溶液的浓度相同,故C正确;
D、X的溶解度随温度升高而增大,将 t1℃时 X 的饱和溶液升温至 t2℃,溶液中溶质和溶剂都是没有改变,X 溶液的浓度不变,故D错误。故选C。

练习册系列答案
相关题目