题目内容
【题目】化学兴趣小组用蜡烛进行了下列实验。
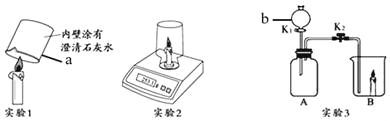
(1)写出标号仪器名称a_____,b_____。
(2)实验1是证明蜡烛中含有_____元素。
(3)实验2中,如果装置不漏气,则电子秤的示数_____(填“变大”“变小”或“不变”)。
(4)实验3中,若B中蜡烛燃烧更旺,A中反应化学方程式为_____;若B中蜡烛熄灭,则A中反应的化学方程式为_____,从灭火原理看蜡烛熄灭的原因是_____。
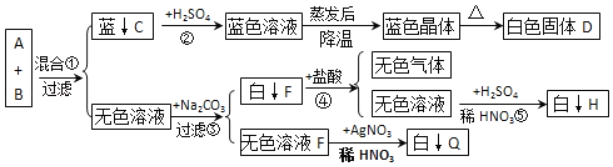
【答案】烧杯 分液漏斗 碳 不变 2H2O2![]() 2H2O+O2↑ CaCO3+2HCl=CaCl2+H2O+CO2↑ 隔绝氧气
2H2O+O2↑ CaCO3+2HCl=CaCl2+H2O+CO2↑ 隔绝氧气
【解析】
(1)a是烧杯,b是分液漏斗;
(2)石蜡燃烧产生的气体能使澄清的石灰水变浑浊,说明有二氧化碳生成,由质量守恒定律可知,石蜡中含有碳元素;
(3)由质量守恒定律可知,化学反应前后物质的总质量不变,所以实验2中,如果装置不漏气,则电子秤的示数不变;
(4)若蜡烛燃烧更旺盛,则产生的是氧气,即过氧化氢在二氧化锰的催化作用下生成水和氧气,反应的化学方程式为:2H2O2![]() 2H2O+O2↑;若熄灭,则是二氧化碳,因为二氧化碳不燃烧、也不支持燃烧,隔绝了氧气,生成二氧化碳的方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑。
2H2O+O2↑;若熄灭,则是二氧化碳,因为二氧化碳不燃烧、也不支持燃烧,隔绝了氧气,生成二氧化碳的方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑。

练习册系列答案
相关题目
【题目】硫酸铜对过氧化氢的分解也有催化作用。取一定质量8.5%的过氧化氢溶液 倒入烧杯中,加入一定质量15%的硫酸铜溶液,过氧化氢完全分解。有关实验数据如表所示(不考虑气体在水中的溶解)。请计算:
(1)生成氧气的质量为___g;
反应前 | 反应后 | ||
实验数据 | 烧杯和过氧化氢溶液的质量∕g | 硫酸铜溶液的质量∕g | 烧杯和烧杯中溶液的质量∕g |
60 | 3.3 | 62.5 | |
(2)过氧化氢溶液的质量_________。