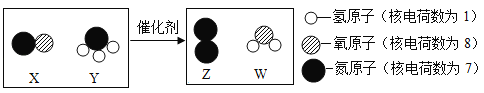
题目内容
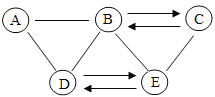
【题目】某溶液含有Cu(NO3)2和AgNO3,现向其中加入一定量的锌粉,参加反应的锌的质量与溶液中金属离子种类的关系(如图所示)。下列说法不正确的是( )
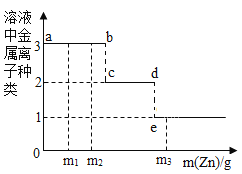
A.当溶液溶质为1种时,金属单质可能为1种
B.从m1变化到m2,溶液中Cu(NO3)2的质量分数变大
C.Cu活动性比Ag强,只用盐酸无法比较两者活动性强弱
D.c~d间(不含c、d两点)的溶液中金属离子为Cu2+、Zn2+
【答案】A
【解析】
锌、铜、银三种金属的活动性由强到弱的顺序是锌、铜、银,所以向含有Cu(NO3)2和AgNO3溶液中加入一定量的锌粉,锌粉先与硝酸银溶液反应生成硝酸锌与银,反应后如果锌有剩余,剩余的锌再与硝酸铜反应生成硝酸锌和铜。
A、当溶液溶质为1种时,原溶液中的硝酸银与硝酸铜全部与锌发生反应,则溶液中的溶质是硝酸锌,得到的金属单质中有银和铜,可能还有剩余的锌,选项错误;
B、由图可知,从m1变化到m2是锌与硝酸银反应的过程中的一段,由反应的化学方程式Zn+2AgNO3=Zn(NO3)2+2Ag可知,参加反应的锌与生成的银的质量比=65:216,则反应后固体质量增加,溶液的质量减少,而该阶段硝酸铜并没有参加反应,所以溶液中Cu(NO3)2的质量分数随溶液的质量减少而变大,选项正确;
C、虽然Cu活动性比Ag强,但两种金属都位于金属活动性顺序表中氢的后面,都不能与酸反应,所以只用盐酸无法比较两者活动性强弱,选项正确;
D、由图可知,c~d间(不含c、d两点)是锌与硝酸铜反应,而硝酸银已经完全反应,所以溶液中的溶质是生成的硝酸锌和未反应的硝酸铜,所以溶液中的金属离子是Cu2+、Zn2+,选项正确,故选A。

练习册系列答案
相关题目