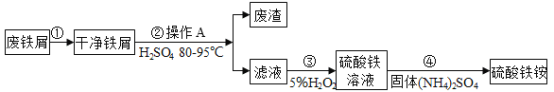
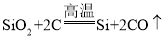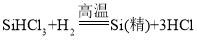��Ŀ����
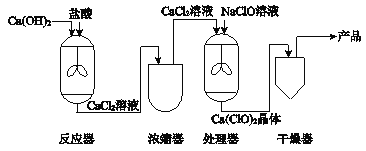
����Ŀ����ͼ������غ��Ȼ��Ƶ��ܽ�����ߣ������ܽ�����ش��������⡣
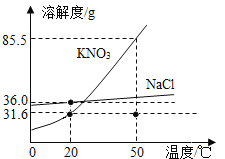
��1������һƿ�ӽ����͵��������Һ��ɱ�����Һ���ɲ�ȡ�ķ���֮һ��_____��
��2����������������Ȼ��ƣ�Ҫ�ᴿ����أ��ɲ���_____�ķ�����
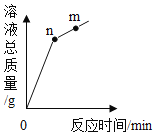
��3��С����100g 20���ˮ�н�������ʵ�飬�õ����Ϊ�٩��ݵ���Һ������˵������ȷ����_____��
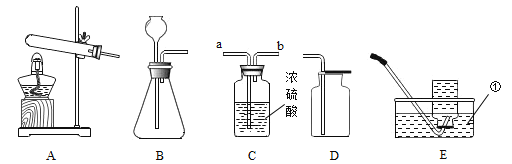
![]()
A �������ʵ������������
B �ڢ������ʵ������������
C �٢ۢ���û�й������
D �ڢܢݵ���ҺΪ������Һ
���𰸡���������ع��壨���»������ܼ��ȣ� ���½ᾧ������ȴ�ȱ�����Һ�� ABC
��������
��1�����ݲ�������Һ�뱥����Һ��ת������������
��2�����ݽᾧԭ��������������
��3�������ܽ������������Һ����������Һ���������
��1������ز�������Һ��ɱ�����Һ���� ��������ع��壨���»������ܼ��Ⱥ������ɣ���
��2������ص��ܽ�����¶����߶����������¶�Ӱ��ϴ��Ȼ��Ƶ��ܽ�����¶�Ӱ��仯����������л����Ȼ��ƣ�Ҫ�ᴿ����أ��ɲ��� ���½ᾧ������ȴ�ȱ�����Һ���ķ�����
��3��С����100g 20���ˮ�н�������ʵ�飬�õ����Ϊ�٩��ݵ���Һ������˵������ȷ���� ABC��
20��ʱ����ص��ܽ��Ϊ31.6g����100gˮ�м���20g����صõ���Һ��Ϊ��������Һ���ټ���40g����أ�ֻ�ܽ�11.6g���õ�����Һ��Ϊ������Һ���ټ�����50�棬50��ʱ����ص��ܽ��Ϊ85.5g���õ�����Һ������������Ϊ20g+40g��60g��Ϊ��������Һ���ټ���20g����أ���������������Ϊ20g+40g+20g��80g���õ�����Һ��Ϊ��������Һ��������20��ʱ�����������80g��31.6g��48.4g����Һ��Ϊ������Һ��
A�������������ʵ�������࣬���������������A��ȷ��
B���ڢݶ���20��ʱ�ı�����Һ�����ʵ�����������ȣ�B��ȷ��
C���٢ۢܶ�Ϊ��������Һ��û�й�����ڣ�C��ȷ��
D���ں͢ݵ���ҺΪ������Һ����Ϊ��������Һ��D����
��ѡABC��
�ʴ�Ϊ����1����������ع��壨���»������ܼ��Ⱥ������ɣ��� ��2�����½ᾧ������ȴ�ȱ�����Һ����
��3��ABC��
�ʴ�Ϊ����1����������2��C����3��BD�� ��4��CH4��

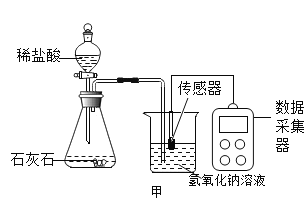
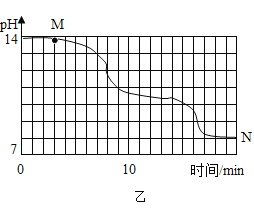
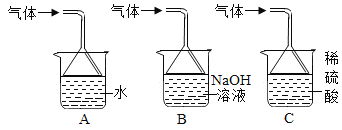
 ���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д�
���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д� ����ѵ��ϵ�д�
����ѵ��ϵ�д�����Ŀ�����A��C����ѡ���������������𣬰�ǰ�����Ʒ֡�
��� | A | B | C |
ʵ�� װ�� |
|
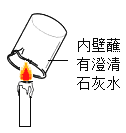
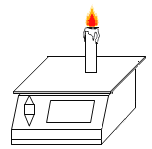
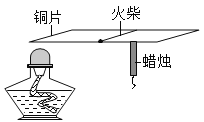
|
|
���� | ��ʵ���Ŀ����_____�� | ���ô�ʵ��ɹ���֤�����غ㶨�ɣ��Ľ��ķ�����_____�� | ��˵��ͭ���е����Ե�������_____�� |