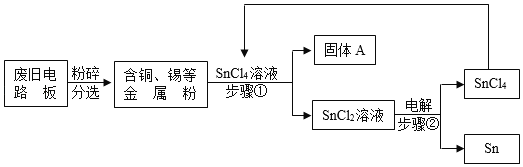
题目内容
【题目】有一包白色粉末,可能含有Ba(OH)2、NaNO3、FeCl3、Na2CO3、Na2SO4中的一种或几种。为了确定其成分,进行如下实验:
①取一定量的白色粉末加入足量的水,振荡,静置,得白色沉淀,上层清液为无色。
②过滤,在白色沉淀中加入足量稀盐酸,白色沉淀全部溶解,且有气泡产生。
(1)据此推断,该白色粉末中一定不含有_________;一定含有__________;可能含有________。
(2)写出步骤①和②中发生反应的化学方程式:
① ____________________
②_____________________
【答案】FeCl3、Na2SO4 Ba(OH)2和Na2CO3 NaNO3 ![]()
![]()
【解析】
①取一定量的白色粉末加入足量的水,振荡,静置,得白色沉淀,上层清液为无色,白色粉末中一定不含氯化铁,因为氯化铁溶液显黄色;得到白色沉淀,氢氧化钡能与硫酸钠反应生成硫酸钡白色沉淀,氢氧化钡能与碳酸钠反应生成碳酸钡白色沉淀。②过滤,在白色沉淀中加入足量稀盐酸,白色沉淀全部溶解,且有气泡产生,碳酸钡能与稀盐酸反应生成氯化钡、二氧化碳和水,硫酸钡与稀盐酸不反应,故白色沉淀为碳酸钡。故白色粉末中一定含氢氧化钡、碳酸钠,一定不含氯化铁、硫酸钠,是否含硝酸钠,无法确定。
(1)由分析可知,该白色粉末中一定不含:FeCl3、Na2SO4;一定含有:Ba(OH)2和Na2CO3;可能含有:NaNO3;
(2)由分析可知,步骤①发生的反应为氢氧化钡与碳酸钠反应生成碳酸钡和氢氧化钠,该反应的化学方程式为:![]() ;步骤②为碳酸钡与稀盐酸反应生成氯化钡、二氧化碳和水,该反应的化学方程式为:
;步骤②为碳酸钡与稀盐酸反应生成氯化钡、二氧化碳和水,该反应的化学方程式为:![]() 。
。

 名校课堂系列答案
名校课堂系列答案【题目】下列实验操作不能达到实验目的的是( )
实验目的 | 实验操作 | |
A | 除去碳粉中的铁粉 | 磁铁吸引 |
B | 除去CO中的少量CO2 | 通入足量的NaOH溶液 |
C | 除去CaO中的少量CaCO3 | 加足量的水,过滤 |
D | 除去NaOH溶液中少量Na2CO3 | 加适量的石灰水,过滤 |
A.AB.BC.CD.D