��Ŀ����
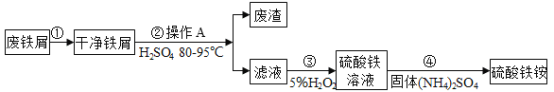
����Ŀ���������[NH4Fe(SO4)2]��һ����Ҫ���Ρ�Ϊ���������Դ�����Ϊ������ʵ������̽�����÷���м���Ʊ�������泥�����������ͼ�����������ͼ�ش��������⡣
��1������۵Ļ�ѧ����ʽΪ![]() ���������ѧ�仯�����У����ϼ۷����ı��Ԫ��Ϊ��_____��
���������ѧ�仯�����У����ϼ۷����ı��Ԫ��Ϊ��_____��
��2������ܷ������Ϸ�Ӧ��д���÷�Ӧ�Ļ�ѧ����ʽ_____��
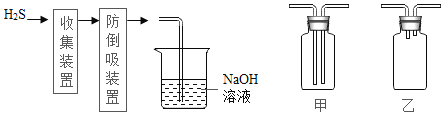
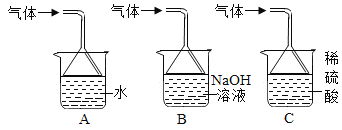
��3������ٻ�����ж���SO2��ͼ�����ʺ�����SO2��ֹ��ɿ�����Ⱦ��װ����_____��
���𰸡�Fe��O ![]() B
B
��������
��1���ɻ��ϼ�ԭ���֪���ڻ�ѧ����ʽΪ2FeSO4+H2O2+H2SO4�TFe2��SO4��3+2H2O����Ԫ����+2�۱�Ϊ+3�ۣ���Ԫ���ɩ�1�ۣ���Ϊ��2�ۣ������������ѧ�仯�����У����ϼ۷����ı��Ԫ��Ϊ��Fe��O��
��2�������̿�֪���ڲ������������������立����˻��Ϸ�Ӧ���÷�Ӧ�Ļ�ѧ����ʽ�ǣ�![]() ��
��
��3�����������������������������Ӧ������ͼ�����ʺ�����SO2��ֹ��ɿ�����Ⱦ��װ����B��
�ʴ�Ϊ����1��Fe��O��
��2��![]() ��
��
��3��B��

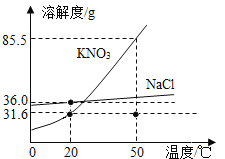
����Ŀ��ijЩ������Һ�нᾧʱ�������ľ����ǽᾧˮ����±���¼��t��Cʱ��4����ͬ������ͭ��Һ�м������ˮ����ͭ�������Լ���������ͭ���壨CuSO4��5H2O����������ʵ�����ݣ�
����ͭ��Һ | �� | �� | III | IV |
�������ˮ����ͭ��g�� | 2.5 | 4.0 | 6.0 | 8.0 |
����������ͭ���壨g�� | 0.10 | 2.8 | 6.4 | 10.0 |
������4.6g��ˮ����ͭʱ����������ͭ���������Ϊ��������
A.2.56gB.3.42g
C.3.88gD.6.82g