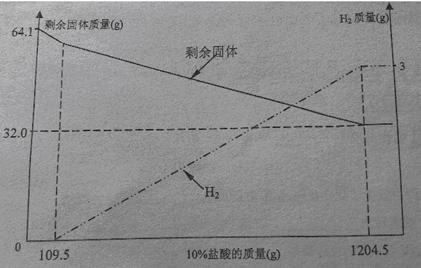
��Ŀ����
ij�����������Ĵ����к�������NaCl���ʣ����Ʒ��װ���ϱ��У�̼���ơ�96%��Ϊ��֤ʵ�ò�Ʒ��̼���Ƶĺ�����ijͬѧȡ12g����Ʒ�����ձ��У��Ƶ��ձ�����Ʒ������Ϊ132.0g�ٰ�100gϡ����ƽ���ֳ�4�μ����ձ��У�ÿ�γ�ַ�Ӧ���ձ���ʣ�������������£���ÿ�η�Ӧ������CO2���嶼ȫ�����ձ����ݳ���
| ����ϡ������� | 1 | 2 | 3 | 4 |
| ����ϡ��������/g | 25 | 25 | 25 | 25 |
| ��ַ�Ӧ���ձ���ʣ����������/g | 155.2 | 178.4 | 202.6 | 227.6 |
������ݱ������ݷ������ٵ�1�γ�ַ�Ӧ�������CO2������������ ��g
�ڸò�Ʒ��̼���Ƶ����������Ƕ��٣��ò�Ʒ�Ƿ�ϸ������ش𣬼�������ȷ��0.1%��
��1.8g�� ��88.3%�����ϸ�
��������������ٸ��ݱ������ݿɵã���һ�μ���ϡ�����ַ�Ӧ�������������̼������Ϊ132g+25��155.2g=1.8g��
����Ʒ��ȫ��Ӧʱ������CO2������Ϊ=132g+100g��227.6g=4.4g
������4.4gCO2����̼���Ƶ�����Ϊx
Na2CO3+2HCl�T2NaCl+H2O+CO2��
106 44
x 4.4g
x=10.6g
�ò�Ʒ��̼���Ƶ���������= ��100%=88.3%
��100%=88.3%
��96%��88.3%
��ò�Ʒ��Na2CO3�������������ϸ�
�𣺢ٵ�һ�μ���ϡ�����ַ�Ӧ�����ɶ�����̼������1.8g���ڸò�Ʒ��̼���Ƶ�����������88.3%���ò�Ʒ��̼���Ƶ������������ϸ�
���㣺���ݻ�ѧ��Ӧ����ʽ�ļ��㣮
����������ÿ�μ���ϡ�����ַ�Ӧǰ�����ʵ��������ɵõ���ַ�Ӧ������������̼���������ɴ������Է�Ӧ������������жϣ���Ϊ�����Ļ���˼·��

���������ͼ��ʾʵ��װ�õ�ʹ�÷�����������ȷ���� ( )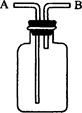
��������ˮ����������ˮ��B������A�ŷ�ˮ
�������ռ��ܶȱȿ���������壺B������A�ŷſ���
�������ռ��ܶȱȿ���С�����壺B������A�ŷſ���
������ϴ����װ��ϴҺ��A������B����
�����ڲ�����������������ˮ��B������A��ˮ���������ˮ�����
| A��ȫ��ȷ | B���ڢۢܢ� | C���٢ۢܢ� | D���٢ڢۢ� |
���й�����ͼװ�õ�˵���У���ȷ����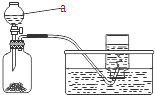
| A����װ���е�����a�dz���©�� |
| B����װ��ʹ��ǰ������������ |
| C����װ�ÿ�����ʵ������ȡ���� |
| D����װ�ó�����ʵ������ȡ������̼ |
��������������ȡ������壬����ʵ�ֵ���
| A����п��ϡ������ȡ���� | B����˫��ˮ�Ͷ���������ȡ���� |
| C��������طֽ���ȡ���� | D����ʯ��ʯ��ϡ������ȡ������̼ |
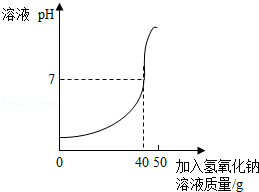

 2NaOH+ Cl2��+ H2��������Ҫ71t������������ˮ��������������Ҫ������10%�Ĵ��ζ��ٶ֣�ͬʱ�����ռ���ٶ֣�
2NaOH+ Cl2��+ H2��������Ҫ71t������������ˮ��������������Ҫ������10%�Ĵ��ζ��ٶ֣�ͬʱ�����ռ���ٶ֣�