题目内容
【题目】水是人类最宝贵的资源。请回答下列问题:
(1)硬水给生活和生产带来很多麻烦,生活中可用_____来区分硬水和软水,常用____的方法来降低水的硬度。
(2)电解水时,连接电源正极端和负极端产生的气体体积之比是 x,电解水的化学方程式中H2和O2的化学计量数之比为y,则x____ (填“>”“<”或“=”)y。该实验可以证明水是由氢、氧两种元素组成的,其理论依据是_____________。
【答案】肥皂水 煮沸 < 质量守恒定律
【解析】
(1)取样,分别加入肥皂水,振荡,泡沫少浮渣多的是硬水,泡沫多的是软水;日常生活中区分硬水与软水;天然水煮沸时,水中的可溶性钙、镁化合物转化为沉淀,水的硬度降低。生活中常常用煮沸方法来降低水的硬度;
(2)通电分解水时,负极上产生的是氢气,正极上产生的是氧气,体积之比是2:1,连接电源正极端和负极端产生的气体体积之比x=![]() ;水在通电的条件下生成氢气和氧气,方程式为:2H2O
;水在通电的条件下生成氢气和氧气,方程式为:2H2O![]() 2H2↑+O2↑,化学方程式中H2和O2的化学计量数之比y=2,所以x<y;由质量守恒定律可知,化学反应前后元素种类不变,所以该实验可以证明水是由氢、氧两种元素组成的。
2H2↑+O2↑,化学方程式中H2和O2的化学计量数之比y=2,所以x<y;由质量守恒定律可知,化学反应前后元素种类不变,所以该实验可以证明水是由氢、氧两种元素组成的。

【题目】下列实验设计不能达到实验目的是( )
编号 | A | B | C | D |
实验设计 |
|
|
|
|
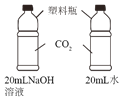
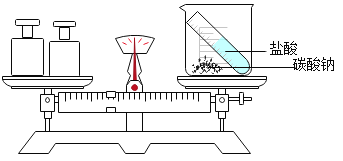
实验 目的 | 探究同种物质在不同 溶剂中的溶解性 | 探究物质燃烧的 条件 | 探究CO2与NaOH 发生反应 | 探究呼出气体与空气 中氧气含量的不同 |
A.AB.BC.CD.D
【题目】过氧化钙(CaO2)是一种环境友好型供氧剂,可用于鱼类养殖、农作物栽培等,实验室有一瓶放置一段时间的过氧化钙样品,某兴趣小组对其成分展开了如下探究。
(查阅资料)CaO2能与水反应最终生成Ca(OH)2和O2;也能与CO2反应得到CaCO3和O2.过氧化氢溶液具有漂白性。
(提出问题)该固体样品的成分是什么?
(猜想假设)可能是CaO2、Ca(OH)2、CaCO3中的一种或几种。
(实验探究)
实验编号 | 实验步骤 | 实验现象 |
① | 取少量样品于试管中,加入一定量的水,一段时间后,在试管口插入带火星的木条 | 得到浊液,有气泡产生,木条复燃 |
② | 另取少量样品于试管中,滴加适量的试剂X,并将产生的气体通入澄清石灰水 | 得到澄清溶液,有气泡产生,生成的气体使石灰水变浑浊 |
③ | 室温下,取①中上层清液,用pH试纸测定溶液的pH | pH约为12 |
(得出结论)
(1)由实验①②可知,白色固体中肯定有_____。
(2)实验②中所加试剂X可以是_____(填字母序号)。
A 稀硫酸 B 稀盐酸 C 水 D 氢氧化钠溶液
(3)根据实验③_____(填“能”或者“不能”)判断原固体样品中含有Ca(OH)2,理由是_____。
(反思交流)(4)过氧化钙敞口放置在空气中,最终会变质为_____(填化学式),原因是_____。
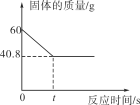
(改进实验)(5)该兴趣小组在老师指导下,用装置甲进行少量过氧化钙样品与足量水反应的实验,实验时加入过氧化钙样品与足量水,迅速密闭装置,开始测氧气浓度。滴入几滴酚酞试液,观察到三颈烧瓶中溶液先变红后慢慢褪色。620秒时,将气球内二氧化锰加入三颈烧瓶中,瓶内氧气浓度随反应时间变化如图乙。

①AB段氧气浓度几乎不变的原因可能是_____;
②滴入酚酞试液后,三颈烧瓶中溶液变红后会慢慢褪色的原因可能是_____。
【题目】某化学兴趣小组使用如图所示装置,对某种锌铜合金的成分进行测量。先取足量稀硫酸于烧杯中,再向其中加入20.0g合金样品。开始计时,并将电子天平的读数记录在下表中,请回答下列问题:

空烧杯 | 加入硫酸后 | 加入合金后5分钟 | 加入合金后12分钟 | 加入合金后21分钟 | 加入合金后40分钟 | 加入合金后3小时 | |
读数(g) | 28.5 | 169.7 | 189.6 | 189.5 | 189.4 | 189.3 | 189.3 |
(1)合金中锌元素的质量分数为多少?
(2)完全反应后.烧杯中盐的质量为多少克? (计算结果精确至0.1g)