题目内容
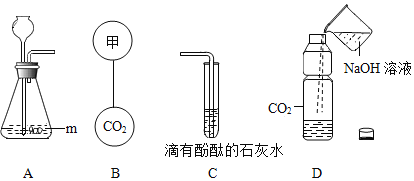
【题目】下列实验设计不能达到实验目的是( )
编号 | A | B | C | D |
实验设计 |
|
|
|
|
实验 目的 | 探究同种物质在不同 溶剂中的溶解性 | 探究物质燃烧的 条件 | 探究CO2与NaOH 发生反应 | 探究呼出气体与空气 中氧气含量的不同 |
A.AB.BC.CD.D
【答案】D
【解析】
A、要注意变量的控制,注意要除探究要素不同之外,其它条件都应该是相同的。
B、根据薄铜片上的白磷和红磷、水中的白磷的燃烧情况,进行分析判断。
C、根据软塑料瓶的变化,进行分析判断。
D、根据氧气能支持燃烧,氧气含量越多,燃烧越旺,进行分析解答。
A、图中实验,溶质相同,溶剂不同,可以探究同种物质在不同溶剂中的溶解性,故选项实验设计能达到实验目的,选项A正确。
B、铜片的白磷燃烧,红磷不燃烧,水中的白磷不能燃烧,薄铜片上的白磷能与氧气接触,温度能达到着火点,水中的白磷不能与氧气接触,红磷温度没有达到着火点;可得出燃烧需要与氧气接触,且温度达到着火点,故选项实验设计能达到实验目的,选项B正确。
C、图中实验盛有氢氧化钠溶液的软塑料瓶变瘪的程度大,可以探究CO2与NaOH能发生反应,故选项实验设计能达到实验目的,选项C正确。
D、氧气能支持燃烧,氧气含量越多,燃烧越旺,图中实验带火星的木条均会熄灭,不能探究呼出气体与空气中氧气含量的不同,应使用燃着的木条,故选项实验设计不能达到实验目的,选项D不正确。
故选D。

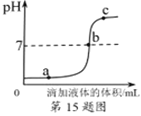
【题目】在食盐中加入适量的碘酸钾(KIO3),可预防碘缺乏病。
(1)人类膳食中缺碘易患_________
A 甲状腺肿大 B 贫血 C 骨质疏松症 D 软骨病
(2)某兴趣小组的同学,欲检测一袋食盐是否为加碘食盐,他们查阅资料得知,加碘食盐中的KIO3在酸性条件下能与KI溶液发生反应,生成碘(I2),淀粉遇I2变蓝色。现提供下列试剂和生活中常见的物质:
①KI溶液;②纯碱:③米汤;④白糖;⑤白酒:⑥白醋,该小组同学进行实验必须选用的试剂和物质是_______________
A ①③④ B ①③⑥ C ②④⑥ D ①④⑤
(3)该小组同学仔细阅读加碘食盐包装袋上的说明后,提出问题并与其他同学讨论,继续进行探究。
问题一:食盐是比较稳定的,而说明中强调“防热”,是否因为受热会造成碘的损失?
(实验一)探究温度对碘损失率的影响
老师指导他们将一定浓度的碘酸钾溶液分成5等份,在不同温度下加热十分钟后,用硫代硫酸
钠标准溶液测定碘酸钾溶液的浓度,计算碘损失率并记录如表:
温度 | 30℃水浴 | 50℃水浴 | 80℃水浴 | 100℃水浴 | 煮沸 |
碘损失率(%) | 0 | 0.3 | 0.67 | 1 | 5.56 |
①分析上表可得出的结论是_____________________________________
②人们常说:“炒菜时要后放碘盐,以免碘的损失。”这里的“碘”指的是____(填“碘单质”、“碘 元素”或“碘原子”)。
问题二:炒菜时加醋对碘的损失率是否也有影响?
(实验二)探究酸碱度对碘损失率的影响
③此组对照实验,要控制在加热的时间和温度、碘酸钾溶液的浓度和______均相同,溶液的酸碱度不同的条件下进行。
④实验需要调节溶液的酸碱性,下列物质不能选用的是_______(填字母)。
A 氢氧化钠 B 纯碱粉末 C 食盐晶体 D 稀盐酸
(4)碘酸钾中碘元素的质量分数为______。我国规定,食盐中加碘的含量为每千克食盐含腆0.035克,相当于每千克食盐含碘酸钾_____克。(精确到小数点后二位)