题目内容
【题目】有一包白色固体,可能含有NaOH、Na2CO3、Na2SO4 、NaCl、 Ba(NO3)2中的一种或几种,为探究其组成,某学习小组设计方案并进行了如下实验:
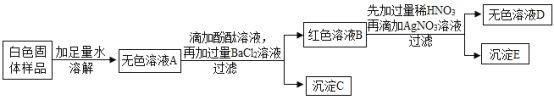
(1)上述实验中,过滤操作用到的玻璃仪器有漏斗、烧杯和______________。
(2)小李同学通过上述实验推知:自色固体样品中一定不含有______________。
(3)为确定白色固体样品中可能存在的物质,小强对沉淀C进行实验。
实验操作 | 现象 | 结论及化学方程式 |
取少量沉淀C于试管中,加入足量稀盐酸 | 有气泡产生,沉淀部分消失 | 白色固体样品中一定含有__________。 该反应的化学方程式为:___________。 |
(4)小明同学认为白色固体中还有物质不能确认其是否存在,其理由是:______________,如要确认,只需将上述实验方案中所加的一种试剂改为______________即可。
【答案】玻璃棒 Ba(NO3)2 Na2CO3、Na2SO4 2HCl+BaCO3=BaCl2+H2O+CO2↑ 氯化钡过量与硝酸银溶液反应也能产生白色沉淀,因此不能确定氯化钠一定存在 Ba(NO3)2溶液(或硝酸钡溶液)
【解析】
(1)过滤操作用到的仪器有铁架台、漏斗、烧杯、玻璃棒。玻璃仪器有漏斗、烧杯和玻璃棒,故填:玻璃棒;
(2)白色固体溶于水形成无色溶液,说明不能同时含有Na2CO3、Na2SO4 、Ba(NO3)2,因为Ba(NO3)2与Na2CO3、Na2SO4 反应能生成BaCO3、BaSO4的白色沉淀;滴加酚酞溶液变红色,说明溶液显碱性,加入过量氯化钡溶液生成沉淀,说明含有Na2CO3、Na2SO4 或其中一种,则白色固体中一定不含Ba(NO3)2,且得到红色溶液B,则说明原白色固体含有NaOH;
向红色溶液中滴加过量的稀硝酸和硝酸银溶液,得到无色溶液和沉淀,说明沉淀不溶于稀硝酸,应为氯化银沉淀,说明溶液B中一定含有氯离子;
(3) 取少量沉淀C于试管中,加入足量稀盐酸,有气泡产生,沉淀部分消失,说明沉淀C部分溶于稀盐酸,故沉淀C是BaCO3、BaSO4的混合物,因此白色固体样品中一定含有Na2CO3、Na2SO4 ;稀盐酸与碳酸钡反应生成氯化钡、水和二氧化碳,反应的化学方程式为:2HCl+BaCO3=BaCl2+H2O+CO2↑;
(4) 小明同学认为白色固体中还有物质不能确认其是否存在,其理由是:氯化钡过量与硝酸银溶液反应也能产生白色沉淀,因此不能确定氯化钠一定存在;如要确认氯化钠的存在,只需将上述实验方案中所加的一种试剂改为硝酸钡即可,碳酸钠与硝酸钡反应生成碳酸钡的沉淀和硝酸钠,不影响氯化钠的测定。

 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
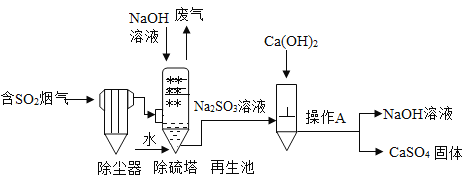
黄冈海淀全程培优测试卷系列答案【题目】某化工厂用废硫酸制备K2SO4的流程如下:
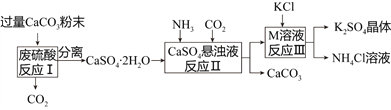
物质 | KCl | K2SO4 | NH4Cl | (NH4)2SO4 |
溶解度/g(20℃) | 34.2 | 11.1 | 37.2 | 75.4 |
(1)生产上将CaCO3研成粉末的目的是________________________________________。
(2)上述流程中,除可综合利用CO2外,还可循环使用的物质是____________________(填写化学式);
(3)写出反应Ⅲ的化学方程式:___________________________________;你认为反应Ⅲ在常温下能实现的原因是__________________________________________________。
(4)洗涤反应Ⅲ所得晶体最好用下列_______(填序号),选择该试剂的原因是___________。
a.BaCl2溶液 b.饱和NH4Cl溶液 c.冷水 d.饱和K2SO4溶液