题目内容
【题目】某化工厂用废硫酸制备K2SO4的流程如下:
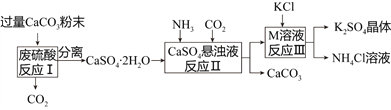
物质 | KCl | K2SO4 | NH4Cl | (NH4)2SO4 |
溶解度/g(20℃) | 34.2 | 11.1 | 37.2 | 75.4 |
(1)生产上将CaCO3研成粉末的目的是________________________________________。
(2)上述流程中,除可综合利用CO2外,还可循环使用的物质是____________________(填写化学式);
(3)写出反应Ⅲ的化学方程式:___________________________________;你认为反应Ⅲ在常温下能实现的原因是__________________________________________________。
(4)洗涤反应Ⅲ所得晶体最好用下列_______(填序号),选择该试剂的原因是___________。
a.BaCl2溶液 b.饱和NH4Cl溶液 c.冷水 d.饱和K2SO4溶液
【答案】 增大CaCO3接触面积,加快后续实验化学反应的反应速率 CaCO3 (NH4)2SO4+2KCl===2NH4Cl+K2SO4↓ 略 d 洗涤时可防止K2SO4晶体溶解
【解析】(1)将CaCO3研成粉末,可以增大反应物的接触面积,其目的是加快反应速率;
(2)观察上述流程,发现二氧化碳和碳酸钙既是反应物也是生成物,故可循环使用的物质有CO2和CaCO3;
(3)由于反应Ⅲ加入氯化钾生成氯化铵和硫酸钾,所以M为硫酸铵,反应的化学方程式:(NH4)2SO4+2KCl=2NH4Cl+K2SO4↓;根据复分解反应发生的条件,反应Ⅲ中虽没有不溶物,但常温下K2SO4的溶解度小,在生成物中会以沉淀的形式出现,故反应可以进行;
(4)a、由于BaCl2与K2SO4反应,所以不能用BaCl2溶液洗涤反应Ⅲ所得晶体;
b、常温下K2SO4的溶解度小,但不意味着不溶,K2SO4会溶解在饱和NH4Cl溶液中,所以不能用饱和NH4Cl溶液洗涤反应Ⅲ所得晶体;
c、常温下K2SO4的溶解度小,但不意味着不溶,K2SO4会溶解在冷水中,所以不能用冷水洗涤反应Ⅲ所得晶体;
d、饱和K2SO4溶液洗涤反应Ⅲ所得晶体的目的是防止K2SO4的溶解,所以能用饱和K2SO4溶液洗涤反应Ⅲ所得晶体。