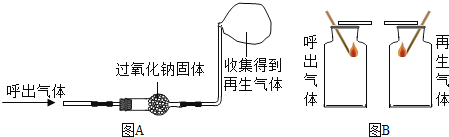
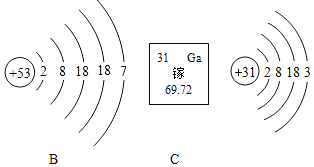
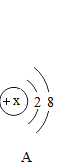��Ŀ����
����Ŀ����1�����мס���������Һ��������ֻ��һ�����ʣ�A���������������е����ʷ�Ӧ��������Ҳֻ��һ�����ʣ�B�������������������ʷ�Ӧ��
�ף� H2SO4��Na2CO3�� Fe��NO3��3
�ң� BaCl2�� HCl�� Ca��OH��2
��д��A��B��Ӧ�Ļ�ѧ����ʽ_____��
��2����8gþп�Ͻ���뵽һ��������һ������������ϡ�����У�ǡ����ȫ��Ӧ������0.5 gH2����Ӧ�����Һ�м���һ������NaOH��Һ��ǡ��ʹ����������MgCl2��ZnCl2��ȫת��Ϊ�����������ɵ�NaCl������Ϊ_____g�������������λС����
���𰸡�Na2CO3+Ca��OH��2=CaCO3��+2NaOH 29.25
��������
��1������������ᷴӦ�����������������Ȼ��������ᷴӦ���ʼ����������������������ʷ�Ӧ����̼���ƣ�����������������������ʷ�Ӧ�����������ƣ�̼�������������Ʒ�Ӧ����̼��Ƴ������������ƣ����Na2CO3+Ca��OH��2=CaCO3��+2NaOH��
��2����8gþп�Ͻ�Ӧ�����������=0.5g��![]() ��100%=18.25g
��100%=18.25g
18.25gHCl��ClԪ�ص�����=18.25g��![]() ��100%=17.75g
��100%=17.75g
��17.75gCl��NaCl������=17.75g��![]() ��100%=29.25g
��100%=29.25g
���29.25��

 ��ʦ����ɳ���ʱͬ��ѧ����ϵ�д�
��ʦ����ɳ���ʱͬ��ѧ����ϵ�д�