题目内容
【题目】往200 克含有稀硝酸和硝酸钙的混合溶液中,加入21.2%的碳酸钠溶液,所得溶液的pH 变化与加入碳酸钠溶液的质量关系如图(假设生成的气体全部逸出),试分析计算:

(1)b点溶液中所含的溶质是 ;
(2)c→d 段溶液的 pH 大于 7 的原因是 ;
(3)反应结束时,生成沉淀的质量是多少?(写出计算过程)
【答案】(1)硝酸钠、硝酸钙;(2)Na2CO3过量,Na2CO3的水溶液呈碱性;(3)20g
【解析】
(1)稀硝酸和硝酸钙的混合溶液中,加入碳酸钠溶液,碳酸钠先与硝酸反应,在a→b段是碳酸钠与硝酸反应生成硝酸钠、二氧化碳和水,b点时稀硝酸和碳酸钠恰好反应完全,所以b点溶液中所含的溶质是硝酸钠、硝酸钙;故填:硝酸钠、硝酸钙。
(2)b→c段是碳酸钠和硝酸钙反应,c点之后碳酸钠溶液过量,碳酸钠溶液显碱性,所以c→d 段溶液的 pH大于7。故填:Na2CO3过量,Na2CO3的水溶液呈碱性。
(3)解:硝酸钙消耗碳酸钠溶液的质量为150g-50g=100g
设生成沉淀的质量为x
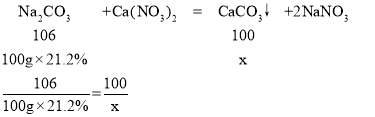
解得x=20g
答:生成沉淀的质量为20g。

练习册系列答案
相关题目