题目内容
【题目】2019年12月17日中国首艘国产航母“山东舰”交付中国海军入列,开拓中国新蓝海。
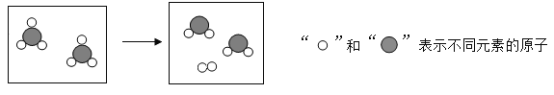
(1)航母甲板上涂有耐高温、耐磨的碳化硅(SiC)涂层,碳化硅的结构类似于金刚石的结构,则构成碳化硅的粒子是__________(填“分子”“原子”或“离子”)。
(2)航母舰体材料为合金钢,国产航母使用的“超级钢”具有极佳的抗压性、延展性和焊接性。合金钢是__________(填“金属”或“合成”)材料。
(3)硝酸铵可用于制造导弹炸药,农业上还可用作__________。
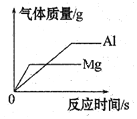
(4)由生铁炼钢时,硅(Si)与氧化亚铁在高温条件下反应生成二氧化硅和铁,该反应的化学方程式为_______,该反应的基本类型为__________。
【答案】原子 金属 氮肥 Si+2FeO![]() SiO2+2Fe 置换反应
SiO2+2Fe 置换反应
【解析】
(1)金刚石由原子构成的,碳化硅的结构类似于金刚石故也为原子构成,故填:原子。
(2)纯金属、合金都属于金属材料,故填:金属。
(3)硝酸铵含氮元素属于氮肥,故填:氮肥。
(4)硅(Si)与氧化亚铁在高温条件下反应生成二氧化硅和铁,化学方程式为Si+2FeO![]() SiO2+2Fe,该反应反应物是单质化合物生成物是单质化合物,符合置换反应特点属于置换反应,故填:Si+2FeO
SiO2+2Fe,该反应反应物是单质化合物生成物是单质化合物,符合置换反应特点属于置换反应,故填:Si+2FeO![]() SiO2+2Fe;置换反应。
SiO2+2Fe;置换反应。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】碳酸钠广泛用于造纸、纺织、制革等工业,是一种重要的化工原料。我国侯德榜发明了将制碱与制氨结合起来的联合制碱法,为碳酸钠的工业化生产作出了巨大贡献。
(查阅资料)侯氏制碱法中主要反应:
Ⅰ.NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl
Ⅱ.2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
(实验探究)小明以粗盐配制饱和食盐水,并采用下列装置模拟制备碳酸氢钠,进而制得碳酸钠。
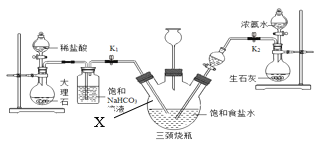
实验操作如下:
①关闭K1,打开K2通入NH3,调节气流速率,待其稳定后,打开K1通入CO2;
②待三颈烧瓶内出现较多固体时,关闭K2停止通NH3,一段时间后,关闭K1停止通CO2;
③将三颈烧瓶内的反应混合物过滤、洗涤、低温干燥,并将所得固体置于敞口容器中加热,记录剩余固体质量。请回答下列问题:
加热时间/min | t0 | t1 | t2 | t3 | t4 | t5 |
剩余固体质量/g | 未记录 | 15.3 | 13.7 | 11.9 | 10.6 | 10.6 |
(1)粗盐中除了含有泥沙等不溶性杂质,还含有少量的MgCl2等。若要除去粗盐中的MgCl2,可加入过量的NaOH溶液,写出对应的化学方程式_____,再过滤,然后向滤液中加入适量_____,得到氯化钠溶液。
(2)饱和NaHCO3溶液的作用是除去CO2中混有的HCl,反应的化学方程式为_____。上述实验装置图中仪器X名称_____。
(3)三颈烧瓶上连接的长颈漏斗的主要作用是_____,有同学认为应该在长颈漏斗内放置一团蘸有酸液的棉花,理由是_____;关闭K2停止通NH3后,还要继续通一段时间CO2,其目的是_____。
(4)根据实验记录,计算t2时NaHCO3固体的分解率(已分解的NaHCO3质量与加热前原NaHCO3质量的比值),请写出计算过程_____。
(拓展延伸)小华设计如图的实验装置测定某纯碱样品(含少量杂质NaCl)中碳酸钠的质量分数:取一定量的样品与足量稀硫酸反应,通过排饱和碳酸氢钠溶液测定生成CO2的体积,计算样品中碳酸钠的质量分数。

(已知常温常压下CO2的密度是1.977g/L)
(1)如果样品质量为5.3g,则实验中选用的量气管规格最合适的是_____(填字母)。
A 500mL B 1000mL C 1500mL D 2000mL
(2)若实验中测得碳酸钠质量分数偏小,下列可能的原因是_____。
a.装置漏气
b.读取数据时量气管的液面低于水准管的液面
c.反应结束后烧瓶中有CO2残留
d.读取数据时仰视读数
e.稀硫酸加入烧瓶占据体积
【题目】下图中直线相连物质间在一定条件下可以发生反应。下表提供的四组物质符合图中要求的是( )
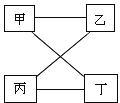
甲 | 乙 | 丙 | 丁 | |
A | Ca(OH)2 | CO2 | NaOH | CuSO4 |
B | Na2CO3 | BaCl2 | HCl | Ca(OH)2 |
C | Zn | HCl | CuCl2 | NaOH |
D | H2 | O2 | HCl | CuO |
A.AB.BC.CD.D